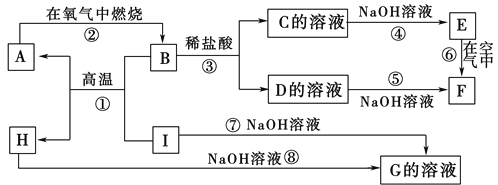
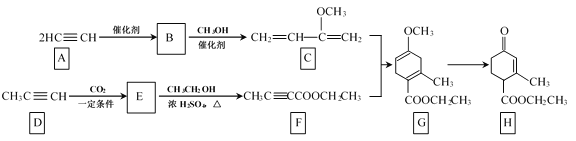
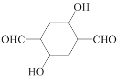
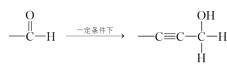
题目内容
【题目】标准状况下两种等物质的量的可燃性气体共1.68L,其中一种是烃,在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g。则这两种混合气体可能为
A.H2与C4H6B.CO与C2H4C.CO与C3H6D.H2与C2H4
【答案】A
【解析】
碳酸钙物质的量为n(CaCO3)=![]() , m(CO2)=0.15mol×44g/mol=6.6g,故燃烧生成水为9.3g-6.6g=2.7g,水的物质的量为
, m(CO2)=0.15mol×44g/mol=6.6g,故燃烧生成水为9.3g-6.6g=2.7g,水的物质的量为![]() ,无色可燃气体A、B总物质的量
,无色可燃气体A、B总物质的量![]() =0.075mol,即0.075mol气体中含有0.15molC,0.3molH,所以1mol气体中含有2molC,4molH,即其平均组成为C2H4Ox。
=0.075mol,即0.075mol气体中含有0.15molC,0.3molH,所以1mol气体中含有2molC,4molH,即其平均组成为C2H4Ox。
A、当H2与C4H6等物质的量混合时,其平均组成为:C2H4,符合题意,故A正确;
B、只要C2H4中含有CO,其平均组成不可能为C2H4Ox,不合题意,故B错误;
C、CO与C3H6混合为使碳原子平均为2,则二者必须等物质的量混合,此时平均为:C2H3O0.5,为使H平均为4,二者必须按1:2混合,此时平均组成为:![]() ,均不合题意,故C错误;
,均不合题意,故C错误;
D、只要C2H4中含有H2其平均组成不可能为C2H4Ox,不合题意,故D错误;
故选A。

练习册系列答案
相关题目