题目内容
1.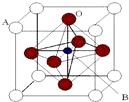 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).(1)用A、B、O表示这类特殊晶体的化学式ABO3.在图中,与A原子配位的氧原子数目为12.
(2)基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,其中电子的运动状态有24种.
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为3:2.
(4)下表是几种碳酸盐的热分解温度和阳离子半径
| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数.对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为558pm.又知钙的密度为1.54g•cm-3,则1cm3钙晶体中含有5.76×1021个晶胞,阿伏伽德罗常数为$\frac{40g/mol×4×5.76×1{0}^{21}}{1.54g/c{m}^{3}×1c{m}^{3}}$=6.0×1023(列式计算).
分析 (1)A位于顶点、B位于体心,O位于面心,结合均摊法计算;晶胞中与A最近的氧原子位于同一平面内的面心和定点,每个晶胞中有$\frac{3}{2}$个O与A距离最近;
(2)Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1;
(3)N和O的价电子排布式分别为2s22p3、2s22p4,以此判断未成对电子数;
(4)从表格中得出:这些物质的阴离子是相同的,均为碳酸根,阳离子的半径越大,分解温度越高;
(5)钙的晶胞为面心立方最密堆积,则晶胞中含有Ca的数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,边长为558pm,则晶胞的体积为(558×10-10cm)3=1.7×10-22cm3,以此可计算1cm3钙晶体中含有晶胞的数目,结合ρ=$\frac{m}{V}$计算阿伏伽德罗常数.
解答 解:(1)A位于顶点、B位于体心,O位于面心,则晶胞中A的个数为8×$\frac{1}{8}$=1,B的个数为1,O的个数为6×$\frac{1}{2}$=3,则化学式为ABO3,晶胞中与A最近的氧原子位于同一平面内的面心和定点,每个晶胞中有$\frac{3}{2}$个O与A距离最近,而A为8个晶胞共有,则与A原子配位的氧原子数目为8×$\frac{3}{2}$=12,
故答案为:ABO3;12;
(2)Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,每个电子的运动状态都不同,则有24种不同的电子,
故答案为:1s22s22p63s23p63d54s1;24;
(3)N和O的价电子排布式分别为2s22p3、2s22p4,则未成对的电子数目比为3:2,故答案为:3:2;
(4)从表格中得出:这些物质的阴离子是相同的,均为碳酸根,阳离子的半径越大,分解温度越高,由于钙离子由于半径小和氧离子结合更为容易,氧化钙晶格能大,所以碳酸钙分解温度低,
故答案为:碳酸盐的热分解是由于晶体中的阳离子结合碳酸根中的氧离子,使碳酸根分解为二氧化碳分子的结果.钙离子由于半径小和氧离子结合更为容易,氧化钙晶格能大,所以碳酸钙分解温度低;
(5)钙的晶胞为面心立方最密堆积,则晶胞中含有Ca的数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,边长为558pm,则晶胞的体积为(558×10-10cm)3=1.74×10-22cm3,
则1cm3钙晶体中含有晶胞的数目为$\frac{1c{m}^{3}}{1.74×1{0}^{-22}{c}^{{m}^{3}}}$≈5.76×1021,ρ=$\frac{m}{V}$=$\frac{\frac{40g/mol×4}{{N}_{A}}}{1.74×1{0}^{-22}c{m}^{3}}$=1.54g•cm-3,
NA=$\frac{40g/mol×4×5.76×1{0}^{21}}{1.54g/c{m}^{3}×1c{m}^{3}}$=6.0×1023,
故答案为:5.76×1021;$\frac{40g/mol×4×5.76×1{0}^{21}}{1.54g/c{m}^{3}×1c{m}^{3}}$=6.0×1023.
点评 本题以科学研究钙钛型复合氧化物作背景,考查学生对电子排布、晶胞计算等知识,侧重于学生的分析、计算能力的考查,难度中等,是对物质结构基础知识和应用能力考查,基础性较强,重点突出.

 每课必练系列答案
每课必练系列答案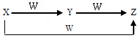 X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )①C、CO ②S、SO2 ③AlCl3、Al(OH)3 ④Cl2、FeCl3.
| A. | 仅有①③ | B. | ①②③ | C. | 仅有②④ | D. | ①②③④ |
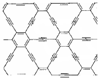 石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能.下列关于石墨炔的说法不正确的是( )
石墨炔是由1,3-二炔键与苯环形成的平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能.下列关于石墨炔的说法不正确的是( )| A. | 石墨炔属于芳香烃 | |
| B. | 石墨炔与金刚石互为同素异形体 | |
| C. | 石墨炔有望代替半导体材料硅在电子产品中得到广泛应用 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
| X | Y | |
| Z | W |
| A. | 最高正化合价:Z>X=W>Y | |
| B. | 原子半径:Y>X>W>Z | |
| C. | 最高价氧化物对应水化物的酸性:Z<X<W<Y | |
| D. | 最高价含氧酸的钠盐溶液能与SO2反应的:X、Y、Z、W |
| A. | 简单离子的半径大小比较:Y>X>Z | |
| B. | 气态氢化物稳定性:X>R | |
| C. | R最高价氧化物对应水化物中既有离子键又有共价键 | |
| D. | Z单质能从M的盐溶液中置换出单质M |
| A. | 若乙为NaHCO3,则丙一定是CO2 | |
| B. | 若A为硝酸,X为金属元素,则甲与丙反应可生成乙 | |
| C. | 若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀 | |
| D. | 若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质 |
| A. | 20mL 0.5mol/L AlCl3溶液 | B. | 30mL 1mol/L KCl溶液 | ||
| C. | 7.5mL 2mol/L MgCl2溶液 | D. | 10mL 3mol/L NaCl溶液 |
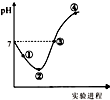 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A. | 曲线起点处水的电离程度最大,可用pH试纸测定溶液pH | |
| B. | ②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO- | |
| C. | 氯气~氯水体系中:c(H+)=c(Cl2)+c(HClO)+c(ClO-) | |
| D. | ③点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) |