题目内容
下列说法正确的是( )
A.6g 12C中约含有3.01×1023个碳原子
B.1 mol任何物质都含有6.02×1023个分子
C.1 mol O2的质量是32 g·mol-1
D.64 g氧相当于2 mol氧
练习册系列答案
相关题目
4.某有机物的结构简式如图所示,下列说法正确的是( )


| A. | 可使溴的四氯化碳溶液或酸性KMnO4溶液褪色 | |
| B. | 含有两种官能团 | |
| C. | 1mol该有机物与足量钠反应可得到0.5molH2 | |
| D. | 可以发生取代反应和加成反应,但不能发生聚合反应 |
5.某晶体中含有极性键,关于该晶体的说法错误的是( )
| A. | 不可能有很高的熔沸点 | B. | 不可能是单质 | ||
| C. | 可能是有机物 | D. | 可能是离子晶体 |
利用实验器材(规格和数量不限)不能完成相应实验的一项是( )
选项 | 实验器材(省略夹持装置) | 相应实验 |
A | 烧杯、玻璃棒、蒸发皿、酒精灯 | CuSO4溶液的浓缩结晶 |
B | 烧杯、玻璃棒、胶头滴管、滤纸、漏斗 | 用盐酸除去BaSO4中少量BaCO3 |
C | 烧杯、玻璃棒、托盘天平、容量瓶 | 用固体NaCl配制0.5 mol·L-1的溶液 |
D | 烧杯、分液漏斗 | 用CCl4萃取碘水中的碘 |
5.实验室欲配制一种仅含4种离子(不考虑、水电离出的离子)的溶液,且溶液中4种离子的浓度均为1mol/L,能达到此目的是( )
| A. | Al3+、K+、SO42-、NO3- | B. | Na+、Mg2+、SO42-、Cl- | ||
| C. | ClO-、I-、K+、Na+ | D. | Ba2+、OH-、CO32-、K+ |
2.比较归纳是化学学习常用的一种方法.对以下三种物质的转化关系,①C→CO2 ②CH4→CO2 ③CO→CO2,比较归纳正确的是( )
| A. | 三种转化关系中发生的反应都属于化合反应 | |
| B. | 三种转化关系中所有的生成物在常温下都是气体 | |
| C. | 三种物质都只能跟氧气反应转化为二氧化碳 | |
| D. | 三种物质都能在点燃条件下转化为二氧化碳 |
1.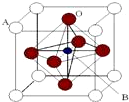 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
(1)用A、B、O表示这类特殊晶体的化学式ABO3.在图中,与A原子配位的氧原子数目为12.
(2)基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,其中电子的运动状态有24种.
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为3:2.
(4)下表是几种碳酸盐的热分解温度和阳离子半径
请解释碳酸钙热分解温度最低的原因:碳酸盐的热分解是由于晶体中的阳离子结合碳酸根中的氧离子,使碳酸根分解为二氧化碳分子的结果.钙离子由于半径小和氧离子结合更为容易,氧化钙晶格能大,所以碳酸钙分解温度低.
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数.对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为558pm.又知钙的密度为1.54g•cm-3,则1cm3钙晶体中含有5.76×1021个晶胞,阿伏伽德罗常数为$\frac{40g/mol×4×5.76×1{0}^{21}}{1.54g/c{m}^{3}×1c{m}^{3}}$=6.0×1023(列式计算).
 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).(1)用A、B、O表示这类特殊晶体的化学式ABO3.在图中,与A原子配位的氧原子数目为12.
(2)基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,其中电子的运动状态有24种.
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为3:2.
(4)下表是几种碳酸盐的热分解温度和阳离子半径
| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数.对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为558pm.又知钙的密度为1.54g•cm-3,则1cm3钙晶体中含有5.76×1021个晶胞,阿伏伽德罗常数为$\frac{40g/mol×4×5.76×1{0}^{21}}{1.54g/c{m}^{3}×1c{m}^{3}}$=6.0×1023(列式计算).


 的物质的量浓度为___________。
的物质的量浓度为___________。 ↑
↑ +OH-+ Ba2+ = BaSO4↓+H2O
+OH-+ Ba2+ = BaSO4↓+H2O