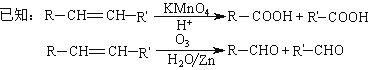题目内容
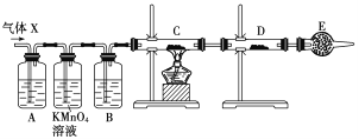
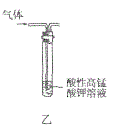
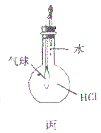
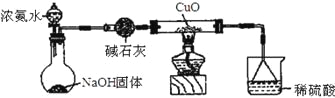
【题目】利用如图所示的装置和其他必要的仪器用品,完成下列实验。
已知2NH3+3CuO![]() N2+3Cu+3H2O,该实验证明氨气具有还原性。
N2+3Cu+3H2O,该实验证明氨气具有还原性。
(1)碱石灰的作用是______________,倒扣漏斗的作用是___________________。
(2)浓氨水与固体NaOH接触,会逸出大量氨气原因是______________________。
(3)硬质玻璃管中可观察到的实验现象是_________________________________。
(4)常温下,若氨水与稀硫酸恰好完全中和,则所得溶液中各离子浓度的大小顺序为_________。
【答案】吸收水蒸气 防止倒吸 NaOH吸水放热,使溶液温度升高,有利于NH3·H2O分解;c(OH-)增大,使NH3+H2O![]() NH4++OH—平衡左移,也有利于氨气的逸出 黑色粉末变为红色,有无色液滴产生 c(NH+4)>c(SO42—)>c(H+)>c(OH-)
NH4++OH—平衡左移,也有利于氨气的逸出 黑色粉末变为红色,有无色液滴产生 c(NH+4)>c(SO42—)>c(H+)>c(OH-)
【解析】
要证明NH3的还原性,需要NH3和氧化性的物质反应,本题选择的是CuO,CuO和NH3反应生成Cu,看到黑色的CuO变成了红色的Cu,可证明NH3的还原性。首先需要制备NH3,用浓氨水和NaOH溶液制备,产生的NH3经碱石灰干燥后进入硬质玻璃管和CuO反应,剩余的NH3用稀硫酸吸收,以防污染环境。
(1)制取的氨气中含有水蒸气,氨气与氧化铜反应需要加热,所以氨气进入硬质试管前应进行干燥,所以碱石灰作用为干燥氨气;吸收过量的氨气防止空气污染,氨气极易被浓硫酸吸收,应防止发生倒吸;故答案为干燥氨气;防止发生倒吸;
(2)一水合氨中存在平衡NH3·H2O![]() NH3↑+H2O,且该反应是吸热反应,向浓氨水中加入NaOH固体,氢氧化钠溶解放出热量促进一水合氨分解生成氨气,另外c(OH-)增大,使NH3+H2O
NH3↑+H2O,且该反应是吸热反应,向浓氨水中加入NaOH固体,氢氧化钠溶解放出热量促进一水合氨分解生成氨气,另外c(OH-)增大,使NH3+H2O![]() NH4++OH—平衡左移,也有利于氨气的逸出。故答案为:NaOH吸水放热,使溶液温度升高,有利于NH3·H2O分解;c(OH-)增大,使NH3+H2O
NH4++OH—平衡左移,也有利于氨气的逸出。故答案为:NaOH吸水放热,使溶液温度升高,有利于NH3·H2O分解;c(OH-)增大,使NH3+H2O![]() NH4++OH—平衡左移,也有利于氨气的逸出;
NH4++OH—平衡左移,也有利于氨气的逸出;
(3)氨气与氧化铜发生氧化还原反应,生成产物为铜,同时生成水,看到现象为:黑色粉末变为红色,有无色液滴产生,故答案:为黑色粉末变为红色,有无色液滴产生;
(4)氨水与稀硫酸恰好完全中和生成硫酸铵,NH4+水解溶液呈酸性,水解是微弱的,所得溶液中各离子浓度的大小顺序为(NH4+)>c(SO42—)>c(H+)>c(OH-),故答案为(NH+4)>c(SO42—)>c(H+)>c(OH-)。

 金钥匙试卷系列答案
金钥匙试卷系列答案