题目内容
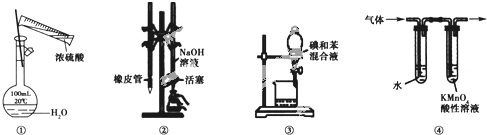
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:
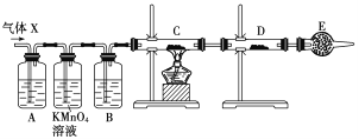
(1)上述反应中生成二氧化硫的化学方程式为______________________________。
(2)乙同学认为还可能产生氢气的理由是__________________________________。
(3)丙同学在安装好装置后,必不可少的一步操作是________________________。
(4)A中加入的试剂可能是_____,作用是__________________________________;B中加入的试剂可能是_____,作用是__________________________________;E中加入的试剂可能是_____,作用是__________________________________。
(5)可以证明气体X中含有氢气的实验现象是:C中:_________________________,D中:_________________________ 。如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?_____ (填“能”或“不能”),原因是______________________________________________________。
【答案】Zn+2H2SO4(浓)==Z nSO4+SO2↑+2H2O 当Zn与浓H2SO4反应时,浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2 检查装置的气密性 品红溶液 检验SO2 浓H2SO4 吸收水蒸气 碱石灰 防止空气中水蒸气进入D中 黑色(CuO)变成红色(Cu) 白色粉末变成蓝色 不能 因为混合气体中含H2O,会干扰H2的检验
【解析】
浓硫酸具有强氧化性,与Zn反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,随着反应的进行,浓硫酸变为稀硫酸,可能发生Zn与稀硫酸反应:Zn+H2SO4=ZnSO4+H2↑,验证H2的存在,通过H2还原氧化铜进行;
(1)生成SO2,发生的化学方程式为Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O;
(2)随着反应进行,浓硫酸的浓度降低,Zn与稀硫酸发生Zn+H2SO4=ZnSO4+H2↑,产生氢气;
(3)需要通入气体,因此实验必不可缺少的一步操作是检验装置的气密性;
(4)根据实验目的,需要检验SO2、H2,检验SO2:利用SO2能使品红溶液褪色,H2不行,因此装置A中盛放的试剂是品红,作用是检验SO2存在;酸性高锰酸钾溶液作用是除去SO2,防止SO2干扰后续实验;检验H2的存在,氢气还原CuO,需要检测H2O,因此装置B中盛放的试剂为浓硫酸,作用是吸收水蒸气,干燥氢气;C装置盛放CuO,D装置盛放无水CuSO4,E装置盛放的试剂可能为碱石灰,防止空气中水蒸气进入D装置,干扰对H2O的检验;
(5)根据(4),证明气体中有氢气,C中现象是黑色变为红色,D中:白色粉末变成蓝色;如果去掉B装置,从高锰酸钾溶液中出来的气体带有水蒸气,对H2的检验产生干扰,因此去掉B装置,不能根据D装置现象判断是否含有H2。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案