题目内容
【题目】关于下列各装置图的叙述中,不正确的是

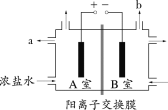
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
【答案】A
【解析】
A、根据图片知,电源的正极是a,负极是b,所以电解池的阳极是c,阴极是d,A错误;
B、H2、NH3、CO2、Cl2、HCl、NO2等气体和氧气不反应,可以采用排空气法进行收集;H2、NH3的密度小于空气密度,可以采用向下排空气法进行收集,即导气管“短进长出”,CO2、Cl2、HCl、NO2的密度大于空气的密度,可以采用向上排空气法进行收集,即导气管“长进短出”,B正确;
C、四氯化碳的密度大于水的密度且和水不互溶,所以四氯化碳和水混合会分层,氨气和氯化氢气体极易溶于水,且不溶于四氯化碳,所以四氯化碳有缓冲作用,可以用此装置吸收NH3或HCl,并可防止倒吸,C正确;
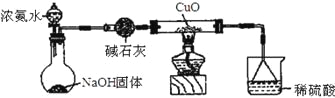
D、碱石灰呈碱性所以能干燥碱性气体氨气,氨气的密度小于空气密度且和氧气不反应,可以用向下排空气法收集氨气,氨气极易溶于水,倒置的漏斗有缓冲作用,所以可以用倒置的漏斗吸收氨气,故D正确;
故选A。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】过氧化钙可用于治理赤潮、应急供氧等。已知:过氧化钙,为白色或淡黄色结晶粉末,难溶于水,不溶于乙醇、乙醚等有机溶剂,常温下干燥品很稳定,能溶于稀酸生成过氧化氢。某小组同学探究过氧化钙的制法和性质:
(1)甲、乙两位同学设计的过氧化钙实验室制法如下,其中产率较低的是______(填A、B)
方法A Ca (OH)2 (s) + H2O2 CaO2 (s) + 2H2O
方法B CaCl2 (s) + H2O2 CaO2 (s) + 2HCl
方法A所得产品中纯度不高,所含杂质主要是 ___________(填化学式)
如果不加入稳定剂,则两种方法都需在5℃以下进行实验,原因可能是______________。
(2)丙同学认为CO2、SO2与过氧化钙的反应原理相同,丁同学认为SO2具有较强的还原性,而CO2没有,故而反应原理不相同。他们设计了如下实验装置,通过测量装置E中所得气体体积判断反应情况:
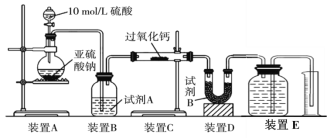
①试剂B的作用是____________________。
②若实验中SO2足量,且与过氧化钙充分反应,取反应后的固体进行探究,以验证过氧化钙与SO2反应的生成物。若SO2未被氧化,则反应的化学方程式为:______________________________。
③装置E中收集到的氧气体积为V L(已换算成标准状况下),若SO2完全被氧化,则V =______。
(3)某工厂利用电石渣(主要成分为氢氧化钙)生产过氧化钙的生产流程如下:
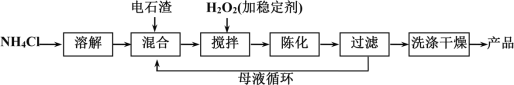
用上述方法制备过氧化钙(CaO2·8H2O),搅拌步骤的化学方程式是______________。
②某小组釆用单变量法确定温度、H2O2浓度对产率的影响,结果如下,则实际生产应选择的适宜条件为__________。
H2O2 % | 30% | 25% | 20% | 15% | 10% | 5% | ||||||
产率 | 60.40 | 62.42 | 64.54 | 63.20 | 63.10 | 62.40 | ||||||
温度(℃) | 50 | 40 | 30 | 20 | 10 | 0 | ||||||
产率 | 43.24 | 52.80 | 64.54 | 63.80 | 60.45 | 52.40 | ||||||