题目内容
【题目】有一含 Na2CO3·xH2O和 NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的 CO2 和 H2O的质量,来确定 Na2CO3··xH2O中 x的数值。
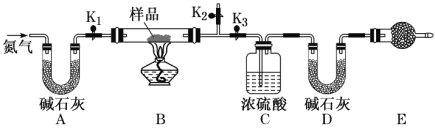
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,检查装置的气密性。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶 C 的质量和盛装碱石灰的 U形管 的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入氮气数分钟,其目的是_________________________。
④关闭活塞K1、K2,打开 K3,点燃酒精灯,加热至不再产生气体。加热时 NaHCO3 发生反应的化学方程式为___________________________________。
⑤打开活塞 K1,缓缓鼓入氮气数分钟,然后拆下装置,再次称量洗气瓶C的质量和 U形管 D的质量。
(2)关于该实验方案,请回答下列问题。
①装置 E的名称是_________,E中盛放的试剂也是碱石灰,其作用是_______________________________。
②若样品质量为 29.3 g,反应后 C、D 装置增加的质量分别为 9 g、4.4 g,则 Na2CO3·xH2O中x为___________。
【答案】除去装置中的水蒸气和二氧化碳 2NaHCO3= Na2CO3+CO2↑+H2O 干燥管(或球形干燥管) 防止空气中的CO2和水蒸气进入D中影响测定结果 x=8
【解析】
根据实验装置及目的可确定,A为吸收氮气中的水蒸气,B为碳酸氢钠及碳酸钠晶体受热分解的装置,C为吸收产生的水蒸气,D为吸收碳酸氢钠分解产生的二氧化碳气体,E为防止空气中的水蒸气、二氧化碳进入装置D,导致测定结果错误,通入氮气为使装置B中产生的水蒸气及二氧化碳均被完全吸收。
(1)③打开活塞K1、K2,关闭K3,缓缓鼓入氮气数分钟,可除去装置中的水蒸气和二氧化碳,使整个装置充满氮气;
④加热时 NaHCO3受热分解生成碳酸钠、二氧化碳和水,化学方程式为2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(2)①装置E为球形干燥管;E的目的为防止空气中的CO2和水蒸气进入D中影响测定结果,可盛有碱石灰;
②C、D 装置增加的质量分别为 9 g、4.4 g,则生成的水的物质的量为0.5mol,二氧化碳为0.1mol,只有碳酸氢钠生成二氧化碳,则n(NaHCO3)=0.2mol,其质量为16.8g,m(Na2CO3·xH2O)=29.3-16.8=12.5g,其含有水蒸气的物质的量=0.5-0.1=0.4mol,则碳酸钠的质量=12.5-0.4×18=5.3g,即0.05mol,n(Na2CO3):n(H2O)=0.05:0.4=1:8,则x=8。