题目内容
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如图:

已知:R-Br![]() RMgBr
RMgBr
(1)A的名称是______,A分子中最多有_____个原子共平面。
(2)D生成E的反应类型为_________。
(3)F的结构简式_________。
(4)J是一种酯,分子中除苯环外还含有一个五元环。写出H生成J的化学方程式_____(注明反应条件)。
(5)E![]()
![]() X,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有______种。
X,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有______种。
(6)利用题中信息和所学知识,写出以甲烷和化合物D为原料,合成 ![]() 的路线流程图_______(其它试剂自选)。
的路线流程图_______(其它试剂自选)。
【答案】2-甲基丙烯 8 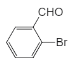 取代反应
取代反应 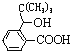
![]()
 +H2O 13
+H2O 13 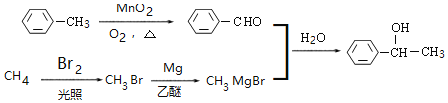
【解析】
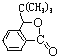
由A、D分子式及G的结构,可知D中含有苯环,A中存在3个碳原子连在同一个碳原子上的结构,A应为![]() ,D为
,D为![]() ,结合G中存在-C(CH3)3结构,可知B为(CH3)3CBr,根据信息反应中第一步可知C为(CH3)3CMgBr;由G的结构,结合信息反应中第二步中与R1COR2的反应,逆推可知F为
,结合G中存在-C(CH3)3结构,可知B为(CH3)3CBr,根据信息反应中第一步可知C为(CH3)3CMgBr;由G的结构,结合信息反应中第二步中与R1COR2的反应,逆推可知F为 ,根据E的分子式可知E为
,根据E的分子式可知E为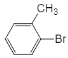 ;根据信息中第一步以及第二步中与二氧化碳的反应,由G可推知H为
;根据信息中第一步以及第二步中与二氧化碳的反应,由G可推知H为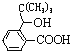 ,结合J的分子式,可知G脱去1分子水形成J,而J是一种酯,分子中除苯环外,还含有一个五元环,则J为
,结合J的分子式,可知G脱去1分子水形成J,而J是一种酯,分子中除苯环外,还含有一个五元环,则J为 。
。
(1)A为![]() ,其名称为2-甲基丙烯;与碳碳双键双键上相连的原子共面,两个甲基中最多有一个氢原子与双键平面共面,所以最多有8个原子共面;
,其名称为2-甲基丙烯;与碳碳双键双键上相连的原子共面,两个甲基中最多有一个氢原子与双键平面共面,所以最多有8个原子共面;
(2)D为![]() ,甲基邻位的氢原子被溴原子代替生成E,所以为取代反应;
,甲基邻位的氢原子被溴原子代替生成E,所以为取代反应;
(3)根据分析可知F为 ;
;
(4)根据分析可知J为 ,H为
,H为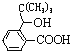 ,羟基和羧基发生酯化生成J,化学方程式为
,羟基和羧基发生酯化生成J,化学方程式为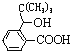
![]()
 +H2O;
+H2O;
(5)根据题中信息可知,
![]()
![]() 最终得到X为
最终得到X为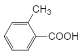 ,其同分异构体满足:
,其同分异构体满足:
①能发生银镜反应,说明含有—CHO结构;
②能与氯化铁溶液发生显色反应,说明含有酚—OH;
若苯环上的取代基为—CH2CHO、—OH,有邻、间、对三种;
若苯环上的取代基为—CHO、—CH3、—OH三个基团,有10种;
共3+10=13种同分异构体;
(6)D为![]() ,甲烷为CH4,产物为
,甲烷为CH4,产物为![]() ,根据合成G的流程可知,合成
,根据合成G的流程可知,合成![]() 可以由
可以由![]() 和CH3MgBr合成,
和CH3MgBr合成,![]() 可以在二氧化锰、氧气、加热条件下氧化得到苯甲醛,溴蒸汽与甲烷混合光照得到一溴甲烷,一溴甲烷与Mg、乙醚作用得到CH3MgBr,所以合成路线为
可以在二氧化锰、氧气、加热条件下氧化得到苯甲醛,溴蒸汽与甲烷混合光照得到一溴甲烷,一溴甲烷与Mg、乙醚作用得到CH3MgBr,所以合成路线为 。
。

【题目】在![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]() ,所得实验数据如下表,下列说法正确的是
,所得实验数据如下表,下列说法正确的是 ![]()
![]()
实验编号 | 温度 | 起始时物质的量 | 平衡时物质的量 | ||
|
|
|
| ||
① | 800 |
|
|
|
|
② | 800 |
|
| a | a |
③ | 900 |
|
|
|
|
A.正反应为放热反应
B.实验①中,反应![]() 达平衡,用X表示的平均反应速率
达平衡,用X表示的平均反应速率![]()
C.实验②中,该反应的平衡常数![]()
D.实验②中,达到平衡时,a大于![]()
【题目】据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及一氧化碳是许多城市大气污染的主要污染物。氮的化合物合成、应用及氮的固定一直是科学研究的热点。
I: (1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH1=-159.47 kJ·mol1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH2=a kJ·mol1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH3=-86.98 kJ·mol1
则a为______。
(2)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=______(空气中氧气的体积含量大约为20%)。
②如图1表示尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为______%。

(3)图2表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式______,生产中可分离出的物质A的化学式为______。
II: 向容积为2L的密闭容器中加入活性炭![]() 足量
足量![]() 和NO,发生反应:
和NO,发生反应:![]()
![]()
![]() △H<0,NO和
△H<0,NO和![]() 的物质的量变化如下表所示。
的物质的量变化如下表所示。
物质的量 |
| T2/0C | |||||
0 |
|
|
|
|
|
| |
NO |
|
|
|
|
|
|
|
| 0 |
|
|
|
|
|
|
(1)T1℃温度下,反应进行了![]() ,用二氧化碳表示该反应的平均反应速率
,用二氧化碳表示该反应的平均反应速率![]() ______。已知:气体分压
______。已知:气体分压![]() 气体总压
气体总压![]() 体积分数。
体积分数。![]() 时用平衡分压代替平衡浓度计算平衡常数
时用平衡分压代替平衡浓度计算平衡常数![]() ______。
______。
![]() 第
第![]() 后,温度调整到
后,温度调整到![]() ,数据变化如上表所示,则
,数据变化如上表所示,则![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
(3)若30min时,保持![]() 不变,向该容器中再加入该四种反应混合物各
不变,向该容器中再加入该四种反应混合物各![]() ,则此时反应______移动
,则此时反应______移动![]() 填“正向”“逆向”或“不”
填“正向”“逆向”或“不”![]() 。
。
【题目】在相同的密闭容器中,用高纯度纳米级Cu2O分别进行催化分解水的实验:2 H2O(g)![]() 2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol/L)的变化结果如下:
2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol/L)的变化结果如下:
序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 60 |
① | 温度T1 / 1号Cu2O | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 温度T1 / 2号Cu2O | 0.0500 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
③ | 温度T2 / 2号Cu2O | 0.0500 | 0.0480 | 0.0470 | 0.0470 | 0.0470 | 0.0470 |
下列说法不正确的是
A. 实验①前20 min的平均反应速率v(O2) = 7×10ˉ5 mol/( L·min)
B. 实验①、②条件下的平衡常数相等,且小于实验③条件下的平衡常数
C. 2号Cu2O的催化效率比1号Cu2O的催化效率高
D. 实验时的温度T2高于T1
【题目】(1)某学生用0.1500 mol/L NaOH溶液测定某未知浓度的盐酸溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写):____→ → F → → → → D。
(2)操作F中应该选择图中滴定管_____(填标号)。

(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察_____。
(4)滴定结果如表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该盐酸的物质的量浓度为_____(精确至0.0001)。
(5)下列操作会导致测定结果偏高的是_____。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
Ⅰ、写出用KMn04滴定H2C2O4的离子方程式_____________________。
Ⅱ、判断滴定终点的方法是________________________。
Ⅲ、计算:血液中含钙离子的浓度为_____mol/L。