题目内容
【题目】据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及一氧化碳是许多城市大气污染的主要污染物。氮的化合物合成、应用及氮的固定一直是科学研究的热点。
I: (1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH1=-159.47 kJ·mol1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH2=a kJ·mol1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH3=-86.98 kJ·mol1
则a为______。
(2)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=______(空气中氧气的体积含量大约为20%)。
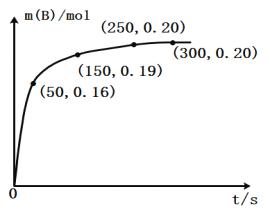
②如图1表示尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为______%。

(3)图2表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式______,生产中可分离出的物质A的化学式为______。
II: 向容积为2L的密闭容器中加入活性炭![]() 足量
足量![]() 和NO,发生反应:
和NO,发生反应:![]()
![]()
![]() △H<0,NO和
△H<0,NO和![]() 的物质的量变化如下表所示。
的物质的量变化如下表所示。
物质的量 |
| T2/0C | |||||
0 |
|
|
|
|
|
| |
NO |
|
|
|
|
|
|
|
| 0 |
|
|
|
|
|
|
(1)T1℃温度下,反应进行了![]() ,用二氧化碳表示该反应的平均反应速率
,用二氧化碳表示该反应的平均反应速率![]() ______。已知:气体分压
______。已知:气体分压![]() 气体总压
气体总压![]() 体积分数。
体积分数。![]() 时用平衡分压代替平衡浓度计算平衡常数
时用平衡分压代替平衡浓度计算平衡常数![]() ______。
______。
![]() 第
第![]() 后,温度调整到
后,温度调整到![]() ,数据变化如上表所示,则
,数据变化如上表所示,则![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
(3)若30min时,保持![]() 不变,向该容器中再加入该四种反应混合物各
不变,向该容器中再加入该四种反应混合物各![]() ,则此时反应______移动
,则此时反应______移动![]() 填“正向”“逆向”或“不”
填“正向”“逆向”或“不”![]() 。
。
【答案】+72.49 1:1 5(±0.5) N2+6e-+8H+=2NH4+ NH4Cl ![]()
![]() > 正向
> 正向
【解析】
I:(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH1=-159.47 kJ·mol1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH2=a kJ·mol1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH3=-86.98 kJ·mol1
依据热化学方程式和盖斯定律①+②=③,得到-159.47+a=-86.98,a=+72.49;
(2)①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳,即1:1,若烟气中V(NO):V(NO2)=5:1时,设通入空气中氧气体积为x,根据2NO+O2=2NO2可知(5-2x):(1+2x)=1:1,计算得x=1,因此空气体积为5,则V(空气):V(NO)=5:5=1:1;
②图象分析可知,当尿素浓度为5mol·L-1左右时,脱氮效率基本不变,所以从经济因素上考虑,一般选择尿素浓度约为5%左右时达到较大的脱氮效率;
(3)以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+;负极是氢气失电子生成氢离子,正极生成铵根离子在电解质溶液中可以分离出氯化铵;
Ⅱ.由表中数据可知,T1时10min达到平衡

①0~5min内,以CO2表示的该反应速率v(CO2)=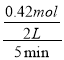 =0.042mol·L-1·min-1,KP为
=0.042mol·L-1·min-1,KP为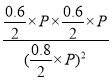 =
=![]() ;
;
②第15min后,温度调整到T2,平衡正向移动,由于该反应为放热反应,则T1>T2;
③若30min时,保持T2不变,K=![]() =4,向该容器中再加入该四种反应混合物各2mol,Qc=
=4,向该容器中再加入该四种反应混合物各2mol,Qc=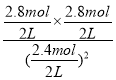 =1.36<K,平衡正向移动。
=1.36<K,平衡正向移动。

 名校课堂系列答案
名校课堂系列答案【题目】I.有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)D﹣的结构示意图是___。
(2)C元素的气态氢化物的化学式为:___;其检验方法:___。
(3)B元素在周期表中的位置___;离子半径:B___A(填“大于”或“小于”)。
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为___,与D的氢化物的水化物反应的离子方程式为___。
II.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(1)NO的平衡浓度c/span>(NO)=___。
(2)图中表示NO2变化的曲线是___,用O2表示0~2s内该反应的平均速率υ=___。
(3)能说明该反应已达到平衡状态的是___。
a.υ(NO2)=2υ(O2) b.容器内气体压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内气体的密度保持不变