题目内容
17.(1)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-12C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81 kJ•mol-1.
(2)在25℃,101KPa时,CO的燃烧热为280kJ/mol,写出 CO的燃烧热的热化学方程式:
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-280kJ/mol.
(3)在火箭推进器中以肼(N2H4)作为燃料,可以选O2或NO2作为氧化剂,如果以氧气作为氧化剂,其化学反应与能量关系如下,

请写出该反应的热化学方程式N2H4(g)+O2(g)=N2(g)+2H2O (g)△H=-534kJ/mol.
分析 (1)已知TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
根据盖斯定律计算分析得到;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合热化学方程式的书写方法写出热化学方程式;
(3)化学反应的焓变等于产物能量和反应物能量之间的差.
解答 解:(1)①TiO2 (s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
依据盖斯定律①+②得到:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ•mol-1;
故答案为:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ•mol-1;
(2)CO的燃烧热为280kJ/mol,则1molCO在氧气中完全燃烧放出的热量为280KJ,因此CO的燃烧热为△H=-283kJ/mol;CO燃烧热的热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-280kJ/mol,
故答案为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-280kJ/mol;
(3)根据化学反应的焓变意义,结合图中给出反应的焓变,得到热化学方程式为:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol,
故答案为:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol.
点评 本题考查了热化学方程式的书写原则和方法应用,燃烧热概念的分析判断,热化学方程式、盖斯定律的计算的计算应用,题目较简单,注意利用方程式相加减的方法处理.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 60g丙醇中存在的共价键总数为10 NA | |
| B. | 1L 0.1mol/L NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA | |
| C. | 钠在空气中可生成多种氧化物.23g钠充分燃烧时转移电子数为1 NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{34}^{136}$Xe+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10 NA |
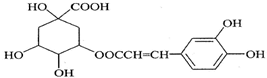
| A. | 分子式为C16H18O9 | |
| B. | 1 mol咖啡鞣酸水解时可消耗8molNaOH | |
| C. | 与苯环上碳直接相连的原子都在同一平面上 | |
| D. | 与浓溴水既能发生取代反应又能发生加成反应 |
| A. | KClO3在反应中失去电子 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1 mol KClO3参加反应有1 mol电子转移 |
| A. | 单位时间内生成a mo1 O2的同时生成2a mol NO2 | |
| B. | 单位时间内生成a mol O2的同时生成2a mol NO | |
| C. | 混合气体的颜色不再改变 | |
| D. | 混合气体的压强不再改变 |
| A. | 稀硫酸滴到铁片上:Fe+H+═Fe2++H2↑ | |
| B. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-═Cu(OH)2↓ | |
| C. | 碳酸钠溶液与稀盐酸反应:CO32-+2H+═H2CO3 | |
| D. | 碳酸氢钠溶液与盐酸混合:HCO3-+H+═H2O+CO2↑ |

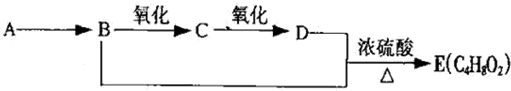
 通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ): $→_{△}^{浓H_{2}SO_{4}}$C3H4O2(Ⅲ)$\stackrel{C_{2}H_{5}OH/H+}{→}$C5H8O2$→_{一定条件}^{HBr}$(Ⅱ)
$→_{△}^{浓H_{2}SO_{4}}$C3H4O2(Ⅲ)$\stackrel{C_{2}H_{5}OH/H+}{→}$C5H8O2$→_{一定条件}^{HBr}$(Ⅱ) .
. ,反应类型是酯化反应(或取代反应).
,反应类型是酯化反应(或取代反应). .
.
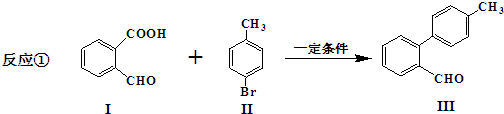
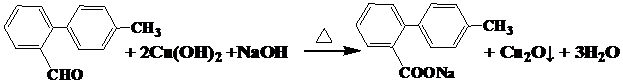 .
.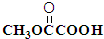 与
与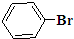 也可以发生类似反应①的反应,有机产物的结构简式为:
也可以发生类似反应①的反应,有机产物的结构简式为: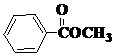 .
.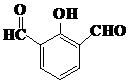 、
、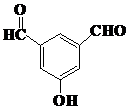 、
、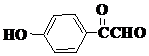 (任意两种).(要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)
(任意两种).(要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)