题目内容
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )

A. Ka1(H2X)的数量级为10-5
B. 曲线N表示pH与![]() 的变化关系
的变化关系
C. NaHX溶液显碱性
D. 当混合溶液呈中性时, ![]()
【答案】A
【解析】A、己二酸是二元弱酸,Ka1=![]() ,曲线N表示pH与
,曲线N表示pH与![]() 的变化关系,当
的变化关系,当![]() =0时,
=0时,![]() =1,Ka1=
=1,Ka1= ![]() 10–4.4,因此Ka1(H2X)的数量级为10–5,选项A正确;B.根据以上分析可知曲线N表示pH与
10–4.4,因此Ka1(H2X)的数量级为10–5,选项A正确;B.根据以上分析可知曲线N表示pH与![]() 的关系,选项B错误;C.曲线N是己二酸的第一步电离,根据图像取0.6和5.0点,
的关系,选项B错误;C.曲线N是己二酸的第一步电离,根据图像取0.6和5.0点,![]() =100.6 mol·L-1,c(H+)=10-5.0 mol·L-1,代入Ka1得到Ka1=10-4.4,因此HX-的水解常数是
=100.6 mol·L-1,c(H+)=10-5.0 mol·L-1,代入Ka1得到Ka1=10-4.4,因此HX-的水解常数是![]() =10-14/10-4.4<Ka2,所以NaHX溶液显酸性,即c(H+)>c(OH-),选项C错误;D.根据图像可知当
=10-14/10-4.4<Ka2,所以NaHX溶液显酸性,即c(H+)>c(OH-),选项C错误;D.根据图像可知当![]() =0时溶液显酸性,因此当混合溶液呈中性时,
=0时溶液显酸性,因此当混合溶液呈中性时,![]() >0,即c(X2–)>c(HX–),选项D错误;答案选A。
>0,即c(X2–)>c(HX–),选项D错误;答案选A。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。

A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
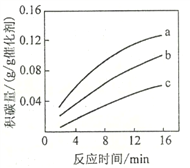
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
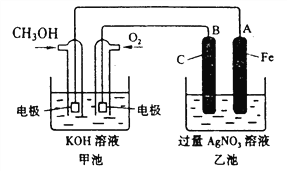
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
【题目】I.在一定条件下aA+bB![]() cC+dD达到平衡时,请填写:
cC+dD达到平衡时,请填写:
(1)若A、B、C、D都是气体,在加压后平衡向逆反应方向移动,则a、b、c、d关系是__________________。
(2)已知B、C、D是气体,现增加A的物质的量,平衡不移动,说明A是__________________(填状态)。
(3)若容器容积不变,加入气体B,气体A的转化率__________________(填“增大”“减小”或“不变”)。
(4)若加热后,C的百分含量减小,则正反应是__________________反应(填“放热”或“吸热”)。
(5)若保持容器压强不变,且A、B、C、D都是气体,向容器中充入稀有气体,则化学平衡正向移动,则a、b、c、d关系是__________________。
Ⅱ.工业上一般采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
(1)在一定温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.5mol·L-1。该反应的平衡常数K=__________________。
(2)若在一体积可变的容器中充入l molCO、 2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________________(填“正”、“逆”)反应方向移动。
(3)若在温度和容积相同的三个密闭容器中,按不同方式投人反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度(mol/L) | 能量变化(Q1、Q2、Q3均大于0) |
1 | 2molCO和4molH2 | a1% | c1 | 放出Q1kJ热量 |
2 | 2molCH3OH | a2% | c2 | 吸收Q2kJ热量 |
3 | 4molCO和8molH2 | a3% | c3 | 放出Q3kJ热量 |
则下列关系正确的是 __________________。
A. c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1 +a2 =1 E.该反应若生成2mol CH3OH,则放出(Q1+Q2)kJ热量