题目内容
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。
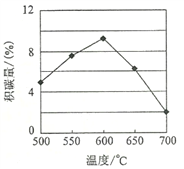
A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
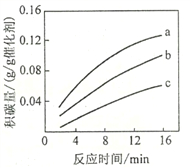
【答案】 247 A ![]() 劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD pc(CO2)、pb(CO2)、pa(CO2)
劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD pc(CO2)、pb(CO2)、pa(CO2)
【解析】分析:(1)根据盖斯定律计算;根据反应特点结合温度和压强对平衡状态的影响解答;根据转化率利用三段式计算平衡常数;
(2)①根据活化能对反应的影响分析;根据反应热结合温度对平衡状态的影响以及图像曲线变化趋势解答;
②根据反应速率方程式分析影响其因素结合图像解答。
详解:(1)已知:
①C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
②C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
③C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
根据盖斯定律可知③×2-②-①即得到该催化重整反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=+247 kJ·mol1。正反应是体积增大的吸热反应,所以有利于提高CH4平衡转化率的条件是高温低压,答案选A;某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,根据方程式可知
CH4(g)+CO2(g)=2CO(g)+2H2(g)
起始浓度(mol/L) 1 0.5 0 0
转化浓度(mol/L) 0.25 0.25 0.5 0.5
平衡浓度(mol/L) 0.75 0.25 0.5 0.5
所以其平衡常数为![]() mol2·L2。
mol2·L2。
(2)①根据表中数据可知相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大,所以催化剂X劣于Y。A.正反应均是吸热反应,升高温度平衡向正反应方向进行,因此K积、K消均增加,A正确;B.升高温度反应速率均增大,B错误;C.根据A中分析可知选项C错误;D.积碳量达到最大值以后再升高温度积碳量降低,这说明v消增加的倍数比v积增加的倍数大,D正确。答案选AD。
②根据反应速率方程式可知在p(CH4)一定时,生成速率随p(CO2)的升高而降低,所以根据图像可知pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为pc(CO2)、pb(CO2)、pa(CO2)。