题目内容
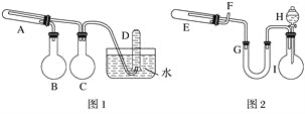
【题目】据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。某兴趣小组用右图模拟该电池工作原理。已知甲池的总反应式为:2CH3OH+3O2+4KOH![]() 2K2CO3+6H2O。请填空:
2K2CO3+6H2O。请填空:
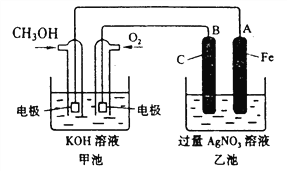
(1)充电时:①原电池的负极与电源_______极相连。
②阳极的电极反应式为____________________________________________。
(2)放电时:负极的电极反应式为_______________________________________________。
(3)某兴趣小组的同学用如图装置进行如下实验:在此过程中若完全反应,乙池中A极的质量升高648g,则甲池中理论上消耗O2 的体积为________L(标准状况下)。
(4)已知常温时CuS的Ksp=1.3×10-36,向100 mL 2×10-18 mol·L-1的K2S溶液中加入100 mL 2×10-18 mol·L-1的CuCl2溶液,试通过计算说明有无CuS沉淀生成(写出计算推理过程,忽略溶液混合时的体积变化)_____________________________________________________________________________。
【答案】 负 4OH--4e-═2H2O+O2↑ CH3OH-6e-+8OH-═CO32-+6H2O 33.6 Qc=c(Cu2+)×c(S2-)=10-18×10-18=10-36<Ksp,所以没有CuS沉淀生成
【解析】(1)①充电时,原电池负极与电源负极相连;②阳极上氢氧根离子失电子发生氧化反应,电极反应式为:4OH--4e-═2H2O+O2↑;(2)放电时,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,所以负极的电极反应式为:CH3OH-6e-+8OH-═CO32-+6H2O;(3)乙池中B极上银离子得电子发生还原反应,当乙池中B极的质量升高648g,则甲池中理论上消耗O2体积=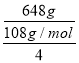 ×22.4L/mol=33.6L;(4)Qc=c(Cu2+)×c(S2-)=10-18×10-18=10-36<Ksp=1.3×10-36,所以没有CuS沉淀生成。
×22.4L/mol=33.6L;(4)Qc=c(Cu2+)×c(S2-)=10-18×10-18=10-36<Ksp=1.3×10-36,所以没有CuS沉淀生成。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案【题目】某同学按下列步骤配制500mL 0.200mol·L-1 Na2CO3溶液,请回答有关问题。
实验步骤 | 有关问题 |
(1)计算所需Na2CO3的质量 | 需要Na2CO3的质量为_________g。 |
(2)称量Na2CO3固体 | 称量过程中主要用到的仪器是_____ |
(3)将Na2CO3加入100mL烧杯中 | 为加快溶解速率,可采取的措施是___ |
(4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应采取的措施是____________________________________________________________________________ |
(5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是______ |
(6)你认为按上述步骤配制的Na2CO3溶液的浓度是否为0.200mol·L-1,请说明理由。________
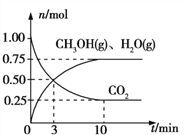
【题目】(题文)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(1)反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
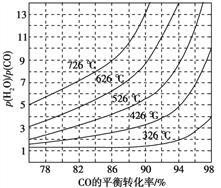
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2_______p 1(填“>”或“<”),得出该结论的理由是________________。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+![]() S↓+2I2+2H2O
S↓+2I2+2H2O
ii.I2+2H2O+_________![]() _________+_______+2 I-
_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。