题目内容
【题目】已知取H2(g)+2ICl(g)=I2(g)+2HCl(g),该反应分①②两步进行,其能量曲线如图所示,下列有关说法正确的是( )
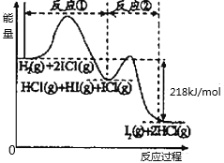
A.反应①为吸热反应
B.反应①和②均是同种元素间发生的氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能有关
D.H2(g) +2ICl(g)=I2(g)+2HCl(g) △H=-218kJ/mol
【答案】C
【解析】
A. 由图像可知,反应①中的反应物的总能量均大于生成物的总能量,为放热反应,故A项错误;
B. 反应①中,氢元素化合价变化:0→+1,碘元素化合价变化:+1→-1;反应②中,HI中碘元素化合价变化:-1→0,ICl中碘元素化合价变化:+1→0,所以反应①、反应②不是同种元素间发生的氧化还原反应,故B项错误;
C. 反应①比反应②的速率慢,由图可知,反应①正反应的活化能比反应②的大,活化能越高则活化分子的百分数越小,化学反应速率越慢,故反应速率与相应正反应的活化能有关,故C项正确;
D. 焓变只与体系的始、末状态有关,而与反应的途径无关,由图像可知,反应前后总的能量变化为218 kJ/mol,所以反应①、反应②的焓变之和为△H=-218 kJ/mol;而H2(g) +2ICl(g)=I2(g)+2HCl(g) 仅是其中的一步反应,所以△H>-218 kJ/mol;故D项错误;
综上所述,本题选C。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式____________。
(2)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),
k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①从0~2s该反应的平均速率v(NO2)=___________。
②T1温度时化学平衡常数K=___________mol-1·L。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T1__________T2 (填“>”、“<”或“=”)。
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是____________________(写出主要反应的离子方程式),该溶液中,c(Na+)______2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的第一步水解平衡常数=________。

【题目】在容积为1 L的密闭容器中,投入1 mol N2和3 mol H2分别在以下不同实验条件下进行反应。下列分析正确的是
容器编号 | 实验条件 | 平衡时反应中的能量变化 |
I | 恒温恒容 | 放热Q1kJ |
II | 恒温恒压 | 放热Q2kJ |
Ⅲ | 恒容绝热 | 放热Q3kJ |
A.放出热量:Q1<Q2B.N2的转化率:I>Ⅲ
C.平衡常数:II>ID.平衡时氨气的体积分数:I>II