题目内容
17.下列离子方程式正确的是( )| A. | 用小苏打类药物治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| B. | FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
分析 A.小苏打为碳酸氢钠,碳酸氢钠与盐酸反应实质为碳酸氢根离子与氢离子反应生成二氧化碳气体和水;
B.根据电荷守恒判断,该离子方程式中电荷不守恒;
C.混合后溶液为中性,则氢氧化钡与硫酸氢钠的物质的量之比为1:2,硫酸根离子过量;
D.醋酸为弱电解质,离子方程式中醋酸不能拆开,应该保留分子式.
解答 解:A.胃酸中主要成分为盐酸,小苏打为碳酸氢钠,二者反应的离子方程式为:HCO3-+H+═CO2↑+H2O,故A正确;
B.FeCl3溶液与Cu的反应生成氯化亚铁和氯化亚铁,离子方程式必须遵循电荷守恒,正确的离子方程式为:Cu+2Fe3+═Cu2++2Fe2+,故B错误;
C.向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性,反应中硫酸根离子过量,正确的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故C错误;
D.醋酸为弱酸,在离子方程式中应该保留分子式,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故D错误;
故选A.
点评 本题考查离子方程式的书写,明确发生的化学反应为解答的关键,为高考常见题型,注意把握量对反应的影响,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
6.下列关于实验现象的描述不正确的是( )
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 | |
| B. | 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 | |
| C. | 马口铁(镀锡铁)破损时与电解质溶液接触,铁先被腐蚀 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
8. 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
 用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
用0.102 6mol•L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )| A. | 22.40 mL | B. | 22.30 mL | C. | 23.65 mL | D. | 23.70 mL |
5.下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞
⑤为保存FeCl3溶液,要在溶液中加少量盐酸.
①NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞
⑤为保存FeCl3溶液,要在溶液中加少量盐酸.
| A. | ①②③ | B. | ②③④ | C. | ①④⑤ | D. | ①②③④⑤ |
12.下列物质属于纯净物的是( )
| A. | 液氯 | B. | 漂白粉 | C. | 新制氯水 | D. | 水玻璃 |
9.结合如图装置判断,下列叙述正确的是( )


| A. | 若X为NaCl,K与M相连时,石墨电极反应为:2Cl--2e-═Cl2↑ | |
| B. | 若X为NaCI,K与N相连时,溶液中有Fe2+生成 | |
| C. | 若X为稀硫酸,K与N相连时,溶液中H+向Fe电极移动 | |
| D. | 若X为稀硫酸,K与M相连时,Fe作负极受到保护 |
7.钠与下列物质反应都能够产生氢气:①H2O;②CH3COOH;③CH3CH2OH 试推断这三种物质电离出H+的难易程度(从难到易的顺序)( )
| A. | ①②③ | B. | ②③① | C. | ③①② | D. | ②①③ |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答: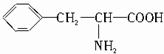 ,B的结构简式为
,B的结构简式为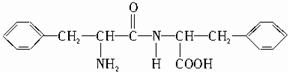 .
.