题目内容
【题目】X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成3种氧化物,其中一种氧化物是具有磁性的黑色晶体。
(1)写出下列元素的名称 X_______,Y________,Z__________
(2)X—H键和Y—H键属于极性共价键,其中极性较强的是________(X、Y用元素符号表示)键。X的第一电离能比Y的________(填“大”或“小”)。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:________________。
(4)W的基态原子的价电子排布式为____________;
(5)Y元素的核外电子轨道表示式为___________。
(6)已知一种Y4分子结构如图所示:
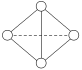
断裂1 mol Y—Y键吸收167 kJ的热量,生成1 mol Y≡Y放出942 kJ热量。则由1molY4气态分子变成2molY2气态分子_______(填写吸收或放出)_______kJ
【答案】碳 氮 硫 N—H 小 ![]() 3d64s2
3d64s2 ![]() 放出 882
放出 882
【解析】
X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6,则其质子数=12-6=6,故X为碳元素;Y元素是动植物生长不可缺少、构成蛋白质的重要组成元素,则Y为氮元素;Z的基态原子核外9个轨道上填充了电子,且核外有2个未成对电子,则Z原子核外电子排布为1s22s22p63s23p4,则Z为S元素;W是一种常见元素,可以形成3种氧化物,其中一种氧化物是具有磁性的黑色晶体,则W为Fe元素。
(1)根据以上分析可知, X是碳元素;Y是氮元素,Z是硫元素;
(2)C—H键和N—H键属于极性共价键,N的电负性大于C,N原子吸引电子的能量强,所以其中极性较强的是N—H键。同周期元素从左到右金属性减弱,所以C的第一电离能比N的小。
(3)C与浓硫酸反应生成二氧化碳、二氧化硫、水,反应的化学方程式是![]() 。
。
(4) W为Fe元素,原子核外有26个电子,其基态原子的外围电子排布式是3d64s2;
(5) Y为氮元素,核外电子轨道表示式为![]() 。
。
(6) 1molN4气态分子,含有6molN-N键,断6molN-N键需要吸收167 kJ×6=1002 kJ的能量,生成2molN2气态分子放出942 kJ×2=1884 kJ的能量,所以由1molN4气态分子变成2molN2分子放出882kJ的能量。