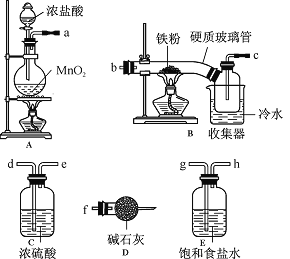
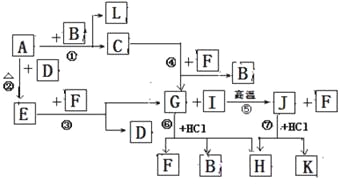
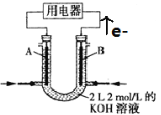
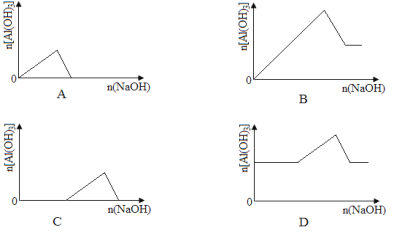
题目内容
【题目】胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:①白色结晶状粉末,可缓缓分解;
②能溶于水;
③遇酸及酸性药物则产生二氧化碳;
④胃酸患者过多服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:①与胃酸作用是中和反应,作用缓慢而持久,可维持3~4小时。
②凝胶本身覆盖于溃疡面上,具有保护作用。
③可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成分是________(填化学式);乙中含有的主要化学成分是________(填化学式)。
(2)试写出甲中含有的主要化学成分引起胃胀气反应的离子方程式:____________________________。
(3)试写出乙中含有的主要化学成分溶于NaOH溶液的离子方程式:____________________________。
【答案】 NaHCO3 Al(OH)3 HCO![]() +H+===H2O+CO2↑ Al(OH)3+OH-===AlO
+H+===H2O+CO2↑ Al(OH)3+OH-===AlO![]() +2H2O
+2H2O
【解析】试题分析:(1)由信息可知,该物质能分解,水解显碱性,与酸反应生成二氧化碳,则甲中物质为碳酸氢钠;乙中物质可溶于稀酸或氢氧化钠溶液,凝胶本身覆盖子溃疡面上,具有保护作用,则乙中含有的主要物质为氢氧化铝;
(2)甲中碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳;
(3)氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水.
解:(1)由信息可知,该物质能分解,水解显碱性,与酸反应生成二氧化碳,则甲中主要物质为碳酸氢钠,其化学式为NaHCO3;乙中物质可溶于稀酸或氢氧化钠溶液,凝胶本身覆盖子溃疡面上,具有保护作用,则乙中含有的主要物质为氢氧化铝,其化学式为Al(OH)3,故答案为:NaHCO3;Al(OH)3;
(2)甲中碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳,该反应的离子方程式为HCO3﹣+H+═CO2↑+H2O,故答案为:HCO3﹣+H+═CO2↑+H2O;
(3)氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,该反应的离子方程式为Al(OH)3+OH﹣=AlO2﹣+2H2O,故答案为:Al(OH)3+OH﹣=AlO2﹣+2H2O.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案