题目内容
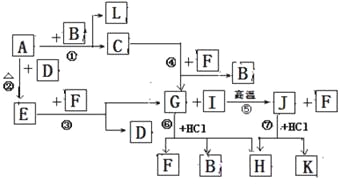
【题目】(14分)下图由短周期元素形成的物质之间的转化关系,其中A、D、L为单质,其他为化合物。其中化合物I、J、K中含有两种相同的元素,G和I的反应⑤是一种重要化工生产中的主要反应之一。B常温下为液态化合物,F是一种直线型的非极性气体分子。
试回答下列有关问题:
(1)以上7个化学反应属于同种元素自身氧化还原反应的是 ;(用编号①→⑦填写)
(2)在G、J、H中含有相同的元素是 (填元素名称);
(3)J的水溶液和F______(填“能”或”否”)发生反应,其理由是 ;
(4)写出电解溶液H的离子反应方程式 ;
(5)反应⑤的化学方程式是 ;
(6)写出J的两种常见用途 、 。
【答案】(1)③;(2)钠;(3)能,碳酸酸性强于硅酸;
(4)2Cl-+2H2O![]() 2OH-+H2↑; (5) Na2CO3+SiO2
2OH-+H2↑; (5) Na2CO3+SiO2![]() Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
(6)木材防火剂,黏合剂。
【解析】试题分析:G和I的反应⑤是一种重要化工生产中的主要反应之一; G和盐酸反应的生成物为三种,所以初步鉴定,G为弱酸含氧盐,生成物为,H为氯酸盐,因为B常温下为液态化合物,所以是水B为水,F为二氧化碳; G是碳酸钠,B是水,F是二氧化碳,I是二氧化硅,J是硅酸钠,H是两个反应的共同产物,故为NaCl,K为H2SiO3;依据转化关系,C为NaOH,A、D、L为单质,A和B反应生成氢氧化钠和L,则A为Na,L为H2,A和D反应生成E,E和F生成碳酸钠和D,推断为E为Na2O2,D为O2。(1)根据推断可知①是置换反应,②是化合反应,③是氧化还原反应,④是复分解反应,⑤是复分解反应,⑥是复分解反应,⑦是复分解反应,所以发生自身氧化还原反应的是过氧化钠和二氧化碳的反应,序号是③;(2)在G为Na2CO3、J为Na2SiO3、H为NaCl,所以三种物质中含有相同的元素是钠元素,元素符号是Na;(3)根据复分解反应的规律:强酸与弱酸的盐反应制取弱酸,可知J(Na2SiO3)的水溶液和F(CO2)反应能反应生成碳酸钠和硅酸,反应的理由是较强酸制较弱的酸;(4)电解溶液H(NaCl)的阴极电极反应方程式是:2H2O+2e-=2OH-+H2↑;(5)反应⑤是二氧化硅和碳酸钠在高温条件下反应生成硅酸钠和二氧化碳,反应的化学方程式是:Na2CO3+SiO2![]() Na2SiO3+CO2↑;(6)J是Na2SiO3,水溶液具有粘性,是一种矿物胶,可作建筑业的黏合剂;该物质不能着火燃烧,是木材的防火剂。
Na2SiO3+CO2↑;(6)J是Na2SiO3,水溶液具有粘性,是一种矿物胶,可作建筑业的黏合剂;该物质不能着火燃烧,是木材的防火剂。