题目内容
【题目】已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
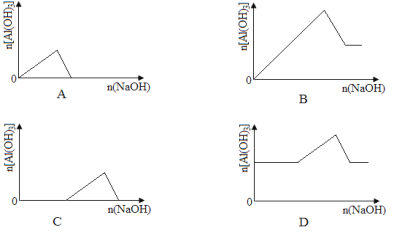
【答案】C
【解析】
试题分析:浓度均为0.1molL-1的Fe(NO3)3和Al(NO3)3混合溶液中,溶液中铁离子、铝离子的浓度相同为0.1mol/L,Al(OH)3的Ksp或溶解度远大于Fe(OH)3,故向混合溶液逐滴加入NaOH溶液,铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,当铝离子沉淀完全,再加入氢氧化钠,氢氧化铝溶解,沉淀的质量减少,由于氢氧化铁不溶于碱,故沉淀减少到一定值不再变化,为氢氧化铁的物质的量。A、向混合溶液逐滴加入NaOH溶液,铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,故开始加入氢氧化钠溶液不能立即产生氢氧化铝沉淀,图象与实际不相符,故A错误;B、向混合溶液逐滴加入NaOH溶液,铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,故开始加入氢氧化钠溶液不能立即产生氢氧化铝沉淀,图象与实际不相符,故B错误;C、铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,当铝离子沉淀完全,再加入氢氧化钠,氢氧化铝溶解,图象与实际相符合,故C正确;D、加入氢氧化钠一定体积后才会产生氢氧化铝沉淀,故D错误;故选C。

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目