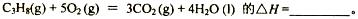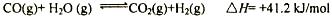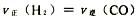题目内容
(3分)氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s)+H2O(g) H2(g)+CO(g)表 ΔH=+131.3 kJ,ΔS=+133.7 J/K
H2(g)+CO(g)表 ΔH=+131.3 kJ,ΔS=+133.7 J/K
该反应在低温下能否自发反应__________(填“能”或“否”)。
(2)已知在400℃时,N2(g)+3H2(g) 2NH3(g)的K′=0.5。
2NH3(g)的K′=0.5。
①2NH3(g) N2(g)+3H2(g)的K=__________(填数值)。
N2(g)+3H2(g)的K=__________(填数值)。
②400℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v(N2)正__________v(N2)逆(填“>”、“<”、“=”或“不确定”)。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s)+H2O(g)
 H2(g)+CO(g)表 ΔH=+131.3 kJ,ΔS=+133.7 J/K
H2(g)+CO(g)表 ΔH=+131.3 kJ,ΔS=+133.7 J/K该反应在低温下能否自发反应__________(填“能”或“否”)。
(2)已知在400℃时,N2(g)+3H2(g)
 2NH3(g)的K′=0.5。
2NH3(g)的K′=0.5。①2NH3(g)
 N2(g)+3H2(g)的K=__________(填数值)。
N2(g)+3H2(g)的K=__________(填数值)。②400℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v(N2)正__________v(N2)逆(填“>”、“<”、“=”或“不确定”)。
(每空1分,共3分) (1)否;(2)2 (3)=
(1)根据△G=△H-T·△S可知,当ΔH=+131.3 kJ,ΔS=+133.7 J/K时,要使反应自发进行,则应该是在高温下。
(2)①逆反应的平衡常数时正反应平衡常数的倒数,所以该反应的平衡常数是1/0.5÷2。
②根据题意可知,此时N2、H2、NH3的物质的量浓度分别是(mol/L)4、2、4,所以此时 ,所以该反应恰好是平衡状态,即正逆反应速率相等。
,所以该反应恰好是平衡状态,即正逆反应速率相等。
(2)①逆反应的平衡常数时正反应平衡常数的倒数,所以该反应的平衡常数是1/0.5÷2。
②根据题意可知,此时N2、H2、NH3的物质的量浓度分别是(mol/L)4、2、4,所以此时
 ,所以该反应恰好是平衡状态,即正逆反应速率相等。
,所以该反应恰好是平衡状态,即正逆反应速率相等。
练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目