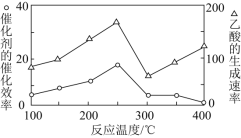
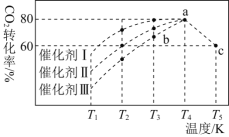
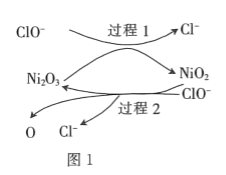
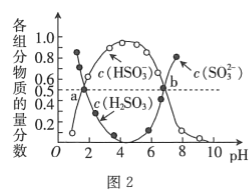
题目内容
【题目】下列微粒中中心原子的杂化方式和微粒的立体构型均正确的是( )
A.C2H4:sp、平面形
B.SO![]() :sp3、三角锥形
:sp3、三角锥形
C.ClO![]() :sp3、V形
:sp3、V形
D.NO![]() :sp3、正四面体
:sp3、正四面体
【答案】C
【解析】
判断杂化轨道类型主要看中心原子周围的σ键数目和孤对电子数目之和,为4是sp3,为3是sp2,为2是sp,而判断空间构型则根据价层电子对互斥理论进行。
A. C2H4中每个C原子周围有3个σ键,无孤对电子,故杂化类型是sp2、空间构型为平面形,故A错误;
B. SO![]() 中每个S原子周围有4个σ键,无孤对电子,故杂化类型是sp3、空间构型为正四面体型,故B错误;
中每个S原子周围有4个σ键,无孤对电子,故杂化类型是sp3、空间构型为正四面体型,故B错误;
C. ClO![]() 中每个Cl原子周围有2个σ键,有2对孤对电子,故杂化类型是sp3、空间构型为V型,故C正确;
中每个Cl原子周围有2个σ键,有2对孤对电子,故杂化类型是sp3、空间构型为V型,故C正确;
D. NO![]() 中每个N原子周围有3个σ键,无孤对电子,故杂化类型是sp2、空间构型为平面形,故D错误;
中每个N原子周围有3个σ键,无孤对电子,故杂化类型是sp2、空间构型为平面形,故D错误;
本题答案为:C

练习册系列答案
相关题目