题目内容
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
![]() 尿素
尿素![]() 是一种非常重要的高效氮肥,工业上以
是一种非常重要的高效氮肥,工业上以![]() 、
、![]() 为原料生产尿素,该反应实际为两步反应:
为原料生产尿素,该反应实际为两步反应:
第一步:![]()
![]()
第二步:![]()
![]()
写出工业上以![]() 、
、![]() 为原料合成尿素和
为原料合成尿素和![]() 的热化学方程式:_________。
的热化学方程式:_________。
![]() 一定温度下,向
一定温度下,向![]() 恒容密闭容器中通入
恒容密闭容器中通入![]() 和
和![]() ,发生反应
,发生反应![]() 。若反应进行到
。若反应进行到![]() 时达到平衡,测得
时达到平衡,测得![]() 的体积分数为
的体积分数为![]() ,则前
,则前![]() 内平均反应速率
内平均反应速率![]() ________,该温度下反应的化学平衡常数
________,该温度下反应的化学平衡常数![]() ________。
________。
![]() 工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收
工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收![]() 。
。
![]() 为了提高吸收效率,常用
为了提高吸收效率,常用![]() 作为催化剂。催化过程如图1所示。
作为催化剂。催化过程如图1所示。
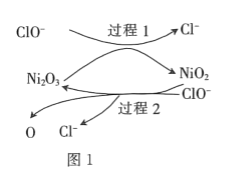
![]() 过程2的反应式为____________。
过程2的反应式为____________。
![]() 也可用于脱硫,且脱硫效果比NaClO更好,原因是_________。
也可用于脱硫,且脱硫效果比NaClO更好,原因是_________。
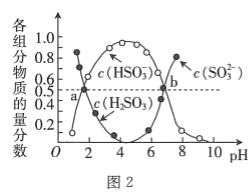
![]() 室温下,
室温下,![]() 溶液中含硫组分物质的量分数随溶液pH的变化关系如图2所示,b点时溶液
溶液中含硫组分物质的量分数随溶液pH的变化关系如图2所示,b点时溶液![]() ,则
,则![]() ________。
________。
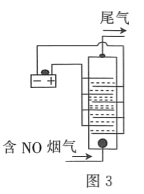
![]() 用食盐水作电解液电解烟气脱氮的原理如图3所示,碱性条件下NO被阳极产生的
用食盐水作电解液电解烟气脱氮的原理如图3所示,碱性条件下NO被阳极产生的![]() 氧化为
氧化为![]() ,尾气经氢氧化钠溶液吸收后排入空气。碱性条件下NO被阳极产生的氧化性物质氧化为
,尾气经氢氧化钠溶液吸收后排入空气。碱性条件下NO被阳极产生的氧化性物质氧化为![]() 的离子方程式为________。
的离子方程式为________。
【答案】![]()
![]()
![]()
![]()
![]()
![]() 和
和![]() 结合生成微溶的
结合生成微溶的![]() 有利于反应的进行
有利于反应的进行 ![]() :1
:1 ![]()
【解析】
(1)已知:①2NH3(g)+CO2(g)=H2NCOONH4(s)△H=-272kJmol-1
②H2NCOONH4(s)=CO(NH2)2(s)+H2O(g)△H=+138kJmol-1,
根据盖斯定律,①+②可得2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g),据此计算△H;
(2)利用三段式法分别找出起始、反应、平衡的量,利用速率公式计算速率。平衡常数代入的是浓度且S(l)不写入平衡常数表达式中;
(3)①a.根据图示可知,转化关系中的过程1是Ni2O3和ClO-发生反应生成NiO2和Cl-,过程2为ClO-与NiO2反应生成Ni2O3、Cl-和O;
b.结合Ca2+与SO42-结合生成微溶的CaSO4分析;
②先判断溶质,写出电荷守恒式,在利用pH=7时,c(H+)=c(OH-)找出其他离子的等量关系,结合图示进行等量删减或替换,最后得出结果;
(4)食盐水做电解液电解烟气(Cl2)脱氮,根据氧化还原反应的规律可得反应;
![]() 已知:第一步:
已知:第一步:![]()
![]() ;
;
第二步:![]()
![]() ;
;
根据盖斯定律,由第一步![]() 第二步可得:
第二步可得:![]()
![]() ;
;
故答案为:![]()
![]() ;
;
![]() 由题知:设转化的
由题知:设转化的![]() 为xmol,则有:
为xmol,则有:
![]()
起始![]() 2 1 0
2 1 0
转化![]() 2x x 2x
2x x 2x
平衡![]()
![]()
![]() 2x
2x
由![]() 的体积分数为
的体积分数为![]() 有:
有:![]() ,解之得:
,解之得:![]() ,故
,故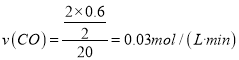 ;
;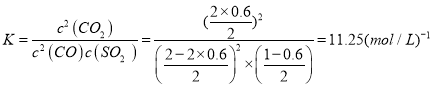 ;
;
故答案为:![]() ;
;![]() ;
;
![]() 由图知,过程2的离子反应方程式为
由图知,过程2的离子反应方程式为![]() ;
;
故答案为:![]() ;
;
![]() 也可用于脱硫,且脱硫效果比NaClO更好,原因是
也可用于脱硫,且脱硫效果比NaClO更好,原因是![]() 和
和![]() 结合生成微溶的
结合生成微溶的![]() 有利于反应的进行;
有利于反应的进行;
故答案为:![]() 和
和![]() 结合生成微溶的
结合生成微溶的![]() 有利于反应的进行;
有利于反应的进行;
![]() 点时溶液的
点时溶液的![]() ,根据电荷守恒可知
,根据电荷守恒可知![]()
![]() ,又根据图象曲线可知:
,又根据图象曲线可知:![]() ,
,![]() :
:![]() :
:![]() :1;
:1;
故答案为:3:1;
![]() 由图知:阳极产生的气体为
由图知:阳极产生的气体为![]() ,NO被
,NO被![]() 氧化为
氧化为![]() 反应的离子方程式
反应的离子方程式![]() ;
;
故答案为:![]() 。
。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】甲醇既是重要的化工原料,又是电动公交车的清洁能源,利用水煤气在一定条件下含成甲醇,发生的反应为:![]() ?
?![]() 已知CO、
已知CO、![]() 、
、![]() 的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol,则
的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol,则![]() ______。
______。![]() 在一容积为2L的恒容密闭容器中加入
在一容积为2L的恒容密闭容器中加入![]() CO和
CO和![]()
![]() ,发生如下反应:CO
,发生如下反应:CO![]() ,实验测得
,实验测得![]() 和
和![]() 下,甲醇的物质的量随时间的变化如表所示,下列说法正确的是
下,甲醇的物质的量随时间的变化如表所示,下列说法正确的是
时间 | 10min | 20min | 30min | 40min | 50min | 60min |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]() 由上述数据可以判断:
由上述数据可以判断:![]() ______
______![]()
![]() 时,
时,![]() 的平均反应速率
的平均反应速率![]() ______。
______。![]() 该反应
该反应![]() 达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是______
达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是______![]() 选填编号
选填编号![]() 。
。
A 改用高效催化剂![]() 升高溫度
升高溫度![]() 缩小容器体积
缩小容器体积 ![]() 分离出甲醇
分离出甲醇 ![]() 增加CO的浓度
增加CO的浓度![]() 若保持
若保持![]() 不变,起始时加入CO、
不变,起始时加入CO、![]() 、
、![]() 的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件______。
的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件______。![]() 当反应在
当反应在![]() 达到20min时,控制体积不变,迅速将
达到20min时,控制体积不变,迅速将![]() ,
,![]() ,
,![]() 同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出20~40min内容器中
同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出20~40min内容器中![]() 浓度的变化趋势曲线:______
浓度的变化趋势曲线:______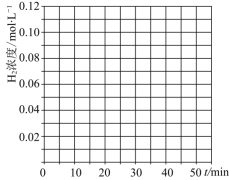
![]() 在以
在以![]() 为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为______;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。
为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为______;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。![]() 燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比
燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比![]()