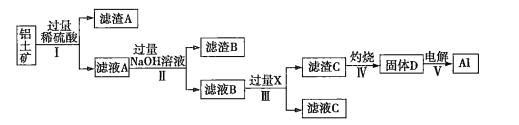
题目内容
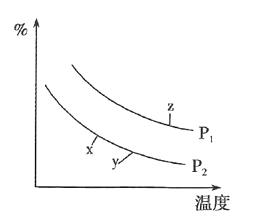
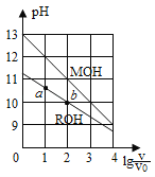
【题目】25℃时,浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示,下列叙述错误的是 ( )
的变化如图所示,下列叙述错误的是 ( )
A.当lg![]() = 2时,若两溶液同时升高温度,则
= 2时,若两溶液同时升高温度,则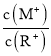 增大
增大
B.MOH的碱性强于ROH的碱性
C.ROH的电离程度:b点大于a点
D.两溶液分别与盐酸反应完全,则消耗HCl的物质的量相同
【答案】A
【解析】
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,未加水稀释前,MOH溶液的pH=13,说明MOH溶液中c(OH-)=c(MOH)=0.1mol/L,则MOH是强电解质;ROH溶液的pH=11,说明ROH溶液中c(OH-)<c(ROH)=0.1mol/L,则ROH是弱电解质,据此分析解答。
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,未加水稀释前,MOH溶液的pH=13,说明MOH溶液中c(OH-)=c(MOH)=0.1mol/L,则MOH是强电解质;ROH溶液的pH=11,说明ROH溶液中c(OH-)<c(ROH)=0.1mol/L,则ROH是弱电解质,
A. 当lg![]() =2时,若两溶液同时升高温度,ROH是弱电解质,升高温度能促进ROH的电离,c(R+)增大,MOH是强电解质,升高温度不影响其电离,则
=2时,若两溶液同时升高温度,ROH是弱电解质,升高温度能促进ROH的电离,c(R+)增大,MOH是强电解质,升高温度不影响其电离,则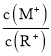 减小,A项错误;
减小,A项错误;
B. 根据分析可知,MOH为强碱,ROH为弱碱,则MOH的碱性强于ROH的碱性,,B项正确;
C. ROH为弱碱,弱电解质在水溶液中随着浓度的减小其电离程度增大,b点溶液体积大于a点,所以b点浓度小于a点,则ROH电离程度:b>a,C项正确;
D. 因为MOH和ROH溶液的浓度均为0.10mol/L、体积均为V0,则二者的物质的量相等,则消耗HCl的物质的量相同,D项正确;
答案选A。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】碳、氮及其化合物在生产、生活中广泛存在。
(1)煤气化的化学方程式为:C(s)+H2O(g)==CO(g)+H2(g) H,该反应在高温下能自发进行,则H_____0(填“>”或“<”)。
(2)煤气化的产物可用于合成甲醇。已知,在刚性容器中,有关反应及其在不同温度下的化学平衡常数如下表所示。
相关化学反应方程式 | 平衡 常数 | 温度(0C) | ||
500 | 700 | 800 | ||
(a)2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
(b)H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
(c)3H2(g)+CO2(g) | K3 | |||
①H1、H2、H3的关系是_____________,H3______0 (填“>”或“<”)
②下列措施能使反应(c)的平衡体系中n(CH3OH):n(CO2)增大的是_______(填字母代号)。
A.将H2O (g)从体系中分离出去 B.充入He (g)
C.升高温度 D.充入1mol H2 (g)
③500℃时,测得反应(c)在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为1.0mol·L-1、0.20mol·L-1、0.50mol·L-1、0.40mol·L-1,则此时反应(c)________。
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断反应状态
(3)CO2

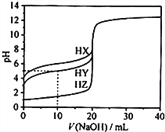
(4)汽车尾气主要有害物质是CO和NO,提高其转化效率是重要的研究课题。在密闭容器中充入5.0 mol CO和4.0 mol NO,发生以下反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。
N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。

①温度:T1_____T2(填“<”或“>”),
② 某温度下,反应达到平衡状态P点时,此时的平衡常数Kp=________________________(只列计算式)。