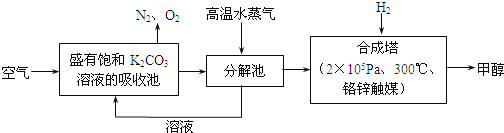
题目内容
【题目】我国是镁资源最为丰富的国家之一.
(1)将1mol镁铝合金(Mg17Al12)完全溶解于12L 6mol/L的盐酸中,放出氢气______mol,为使反应后溶液中的Mg2+、Al3+完全沉淀,需加入10mol/L的氨水至少______L。
(2)灼烧碱式碳酸镁可得到MgO.取碱式碳酸镁4.66g,灼烧至恒重,得到2g固体和1.76g CO2,某学生为确定碱式碳酸镁的化学式列了以下联立方程:
24+17x+60y+18z=4.66÷(![]() )…①
)…①
2﹣x﹣2y=0…②
(![]() )×(0.5x+z)×18=4.66﹣2﹣1.76…③
)×(0.5x+z)×18=4.66﹣2﹣1.76…③
(a)①式表达的是求算碱式碳酸镁摩尔质量的关系式,则②式表达的是_______________;
(b)以上关系式是正确的,据此可求出该碱式碳酸镁的化学式为________________________________。
(3)氧化镁可用于烟气脱硫,反应原理为:
MgO+H2O=Mg(OH)2 Mg(OH)2+SO2=MgSO3+H2O
MgSO3+H2O+SO2=Mg(HSO3)2 2MgSO3+O2=2MgSO4
某小组模拟脱硫过程如下(实验在25℃进行):将MgO加入水中,不断搅拌,通入SO2和空气,得到550g滤液和若干克滤渣.取55g滤液依次加入足量的盐酸和BaCl2溶液,得到0.897g白色沉淀;另取55g滤液加入足量氯水和BaCl2混合溶液,得到1.992g白色沉淀.分析知滤渣中含MgSO3 16.82g(其它成分不含硫元素)。
①该实验过程中吸收的SO2的物质的量为________mol;消耗氧气的物质的量为_______mol。
②Mg(HSO3)2易溶于水;25℃溶解度,MgSO4:33.7g/100g水;MgSO3:0.652g/100g水.试通过计算确定550g滤液中镁盐的成分及物质的量(写出计算过程)___________________________。
【答案】35 7.2 电荷平衡(或化合物化合价代数和为零) Mg(OH)24MgCO34H2O或Mg5(OH)2(CO3)44H2O或Mg(OH)0.4(CO3)0.80.8H2O 0.247 0.0192 550g滤液中镁盐的成分为Mg(HSO3)2,物质的量为0.00635mol
【解析】
(1)n(HCl)=12L×6mol/L=72mol,Mg~2HCl、Al~3HCl,以此计算生成的氢气;酸碱恰好中和时Mg2+、Al3+完全沉淀;
(2)(a)②式与化合物中正负化合价代数和为0有关;
(b)以上关系式是正确的,联立方程计算x、y、z,可得碱式碳酸镁的化学式;
(3)0.897g白色沉淀为硫酸钡;另取55g滤液加入足量氯水和BaCl2混合溶液,得到1.992g白色沉淀为硫酸钡,滤渣中含MgSO316.82g,结合硫原子守恒计算二氧化硫的物质的量,结合电子守恒计算氧气的量;确定550g滤液中镁盐的成分为Mg(HSO3)2,结合上述反应及守恒计算。
(1)n(HCl)=12L×6mol/L=72mol,Mg~2HCl、Al~3HCl,1mol镁铝合金(Mg17Al12)消耗HCl为17mol×2+12mol×3=70,生成的氢气为![]() =35mol;酸碱恰好中和时Mg2+、Al3+完全沉淀,则需加入10mol/L的氨水至少
=35mol;酸碱恰好中和时Mg2+、Al3+完全沉淀,则需加入10mol/L的氨水至少![]() =7.2L;
=7.2L;
(2)(a)②式与化合物中正负化合价代数和为0有关,即2﹣x﹣2y=0表达的是电荷平衡(或化合物化合价代数和为零);
(b)24+17x+60y+18z=4.66÷![]() ①,2﹣x﹣2y=0 ②,
①,2﹣x﹣2y=0 ②,![]() ×(0.5x+z)×18=4.66﹣2﹣1.76③,x表示OH﹣个数,y表示碳酸根离子个数,z表示水分子个数,以上关系式是正确的,联立方程可得Mg、x、y、z的个数比为5:2:4:4,所以碱式碳酸镁的化学式为Mg(OH)24MgCO34H2O 或Mg5(OH)2(CO3)44H2O或Mg(OH)0.4(CO3)0.80.8H2O;
×(0.5x+z)×18=4.66﹣2﹣1.76③,x表示OH﹣个数,y表示碳酸根离子个数,z表示水分子个数,以上关系式是正确的,联立方程可得Mg、x、y、z的个数比为5:2:4:4,所以碱式碳酸镁的化学式为Mg(OH)24MgCO34H2O 或Mg5(OH)2(CO3)44H2O或Mg(OH)0.4(CO3)0.80.8H2O;
(3)0.897g白色沉淀为硫酸钡;通入SO2和空气,得到550g滤液,另取55g滤液加入足量氯水和BaCl2混合溶液,得到1.992g白色沉淀为硫酸钡,滤渣中含MgSO3 16.82g,
①由S原子守恒可知,n(SO2)=![]() +
+![]() =0.247mol,由生成0.897g沉淀时电子守恒可知n(O2)=
=0.247mol,由生成0.897g沉淀时电子守恒可知n(O2)= =0.0192 mol;
=0.0192 mol;
②MgSO3不溶于水,硫酸根离子转化为沉淀,则550g滤液中镁盐的成分为Mg(HSO3)2,
n(BaSO4)= n(MgSO4)=![]() =0.0384mol,m(MgSO3)=550g×
=0.0384mol,m(MgSO3)=550g×![]() =3.563g,n(MgSO3)=
=3.563g,n(MgSO3)=![]() =0.0343mol,则由Mg(HSO3)2 产生的n(BaSO4)=
=0.0343mol,则由Mg(HSO3)2 产生的n(BaSO4)=![]() ﹣0.0384mol﹣0.0343mol=0.0127mol,所以n[Mg(HSO3)2]=
﹣0.0384mol﹣0.0343mol=0.0127mol,所以n[Mg(HSO3)2]=![]() =0.00635mol。
=0.00635mol。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8molL﹣1 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为________。
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)c(OH﹣) D.c(OH-)/ c(H+) E.c(H+)c(CH3COO-)/ c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是________。
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:

则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)________(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是____________________。
(4)已知100℃时,水的离子积为1×10﹣12, 该温度下测得某溶液pH=7,该溶液显________(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a∶b=________。