题目内容
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol·L-1) | 10 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
c(CO)/(10-3mol·L-1) | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1) 已知该反应ΔS<0,在上述条件下反应能够自发进行,则反应的ΔH________0(填写“>”“<”或“=”)。
(2)前2 s内的平均反应速率v(N2)=________。
(3)在该温度下,反应的平衡常数表达式K=________。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
【答案】<1.9×10-4 mol·L-1·s-1![]() CD
CD
【解析】
(1)反应自发进行,说明ΔH-TΔS<0,该反应的ΔS<0,故答案为:< ;(2)2 s时,Δc(NO)=7.5×10-4 mol·L-1,v(NO)=3.75 ×10-4 mol·L-1·s-1,反应速率比等于方程式化学计量数之比,v(N2)=1.875×10-4 mol·L-1·s-1,小数点后保留一位有效数字,应为1.9×10-4 mol·L-1·s-1;(3)由反应方程式可知 K=![]() ;(4)提高NO转化率,即平衡右移,A项使用催化剂不影响平衡;B项升高温度,平衡左移,C项降低温度,平衡右移;D项缩小容器体积,相当于加压,平衡右移,故答案为:CD。
;(4)提高NO转化率,即平衡右移,A项使用催化剂不影响平衡;B项升高温度,平衡左移,C项降低温度,平衡右移;D项缩小容器体积,相当于加压,平衡右移,故答案为:CD。

【题目】CO、CO2是含碳元素的常见气体,也是参与碳循环的重要物质。研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0 kJ·mol-1;
C(s) +CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为______________________________。
(2)甲醇是重要的化工原料,利用煤化工中生产的CO和H2可制取甲醇,发生的反应为CO(g)+2H2(g) ![]() CH3OH(g)。实验室中,在1L恒容的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
CH3OH(g)。实验室中,在1L恒容的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
10min | 20min | 30min | 40min | 50min | 60min | |
300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
①300℃和500℃对应的平衡常数大小关系为K300℃_________K500℃(填“>”、“=”或“<”)。
②下列关于该反应的说法正确的是______________(填选项字母,下同)
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.温度一定时,压强不再随时间变化可以说明反应达到了平衡状态
D.使用高效催化剂,ΔH会增大
③300 ℃时,前10 min内,该反应的平均反应速率为v(H2)=___mol/(L·min)。
④下列措施能够增大此反应中CO的转化率的是_________。
A. 充入CO气体 B. 升高温度
C. 使用优质催化剂 D. 往容器中再充入1 mol CO和2 mol H2
⑤500 ℃时,保持反应体系的温度不变,60min时再向容器中充入CH3OH气体和H2各0.4mol,反应将向___(填“正反应方向”、“逆反应方向”或“不”)进行。再次达到平衡时的平衡常数为____________L2/mol2。
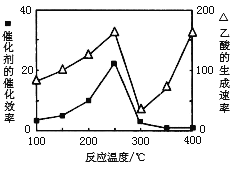
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见下图。当乙酸的生成速率主要取决于温度时,其影响范围是__________________。
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
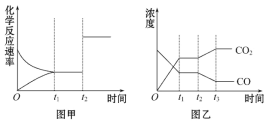
①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。