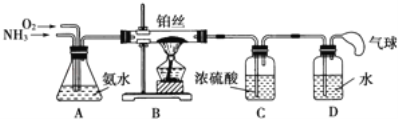
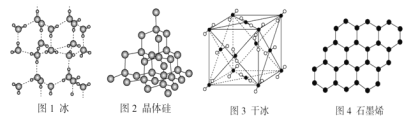
题目内容
【题目】有四种短周期元素,它们的结构、性质等信息如下表所示:
元素 | 结构、性质等信息 |
A | 是元素周期表中(除稀有气体外)原子半径最大的元素,该元素某种合金是原子反应堆导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
E | L层上有2对成对电子 |
请根据表中信息填写:
(1)B原子的简化电子排布式_____。
(2)A元素在周期表中的位置_____;离子半径:A_____B(填>、=或< )。
(3)E原子的价电子排布图是____,其原子核外有______个未成对电子,能量最高的电子为_____轨道上的电子,其轨道呈_____形。
(4)D原子的外围电子排布式为____,D-的离子结构示意图是_____。
(5)C、E元素的第一电离能的大小关系是_____(用元素符号表示,下同)。
(6)已知CD3分子中D元素为+1价,则C、D的电负性大小关系是____,CD3的中心原子杂化轨道类型是___,CD3与水反应的化学方程式是_____。
【答案】[Ne]3s23p1 第三周期第ⅠA族 > ![]() 2 p或2p 哑铃 3s23p5
2 p或2p 哑铃 3s23p5 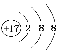 N>O N>Cl sp3 NCl3+4H2O=NH3·H2O+3HClO或NCl3+3H2O=NH3+3HClO
N>O N>Cl sp3 NCl3+4H2O=NH3·H2O+3HClO或NCl3+3H2O=NH3+3HClO
【解析】
先根据元素的结构、性质等推断元素。A是元素周期表中(除稀有气体外)原子半径最大的元素,该元素某种合金是原子反应堆导热剂,则A是Na元素;B与A同周期,其最高价氧化物的水化物呈两性,则B是Al元素;元素C的气态氢化物极易溶于水,可用作制冷剂,则C是N元素,该氢化物是NH3;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D是Cl元素;E元素的L层上有2对成对电子,则E核外电子排布是1s22s22p4,E是O元素。然后结合原子核外电子排布规律、元素周期律及元素和化合物的性质逐一分析解答。
根据上述分析可知:A是Na;B是Al;C是N;D是Cl;E是O元素。
(1)B是Al元素,其原子核外电子排布式是1s22s22p63s23p1,Al的简化电子排布式[Ne] 3s23p1;
(2)A是Na,核外电子排布是2、8、1,故该元素在周期表中的位置是位于第三周期第IA族;Na+、Al3+核外电子排布都是2、8,由于核电荷数越大,离子半径越小,所以离子半径:Na+>Al3+;
(3)E是O,O核外电子排布式是1s22s22p4,故O原子的价电子排布图是![]() ;其原子核外有2个未成对电子;能量最高的电子为2p轨道上的电子,其轨道呈哑铃形或纺锤形;
;其原子核外有2个未成对电子;能量最高的电子为2p轨道上的电子,其轨道呈哑铃形或纺锤形;
(4)D是Cl,原子的外围电子排布式为3s23p5,Cl-是Cl原子得到1个电子形成的微粒,故Cl-的离子结构示意图是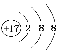 ;
;
(5)C是N,核外电子排布式为1s22s22p3;E是O,O元素的核外电子排布式为1s22s22p4;由于N元素的最外层电子2p电子处于半充满的稳定状态,失去1个电子比O元素难,故N元素第一电离能比O元素的第一电离能的大,即第一电离能:N>O;
(6)在NCl3分子中Cl元素为+1价,N为+3价,说明N、Cl的电负性大小关系是:N>Cl;在NCl3中N元素形成了3对共用电子对,N原子上还有1对孤电子对,故N原子的杂化轨道类型是sp3杂化,NCl3与水反应产生NH3和HClO,该反应的化学方程式是NCl3+3H2O=NH3+3HClO,也可以写为NCl3+4H2O=NH3·H2O+3HClO。