题目内容
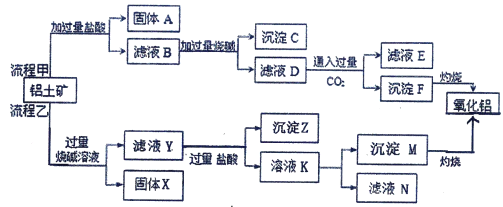
【题目】某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( ) 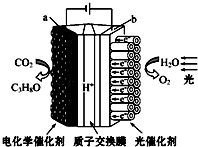
A.该装置将化学能转化为光能和电能
B.a电极的反应为:3CO2+18H+﹣18e﹣═C3H8O+5H2O
C.每生成1 mol O2 , 有44 g CO2被还原
D.该装置工作时H+从b极区向a极区迁移
【答案】D
【解析】解:A、该装置是电解池装置,是将电能转化为化学能,所以该装置将光能和电能转化为化学能,故A错误;B、a与电源负极相连,所以a是阴极,发生还原反应,电极反应式为:3CO2+18H++18e﹣=C3H8O+5H2O,故B错误;
C、电池总的方程式为:6CO2+8H2O ![]() 2C3H8O+9O2 , 即生成9mol的氧气,阴极有6mol的二氧化碳被还原,也就是1mol的氧气,阴极有
2C3H8O+9O2 , 即生成9mol的氧气,阴极有6mol的二氧化碳被还原,也就是1mol的氧气,阴极有 ![]() mol的二氧化碳被还原,所以被还原的二氧化碳为29.3g,故C错误;
mol的二氧化碳被还原,所以被还原的二氧化碳为29.3g,故C错误;
D、a与电源负极相连,所以a是阴极,而电解池中氢离子向阴极移动,所以H+从阳极b极区向阴极a极区迁移,故D正确;
故选D.

【题目】有A,B,C,D,E五种元素,其相关信息如表:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C基态原子的2p轨道中有3个未成对电子 |
D | D是主族元素且与E同周期,其最外能层 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式 .
(2)C元素的第一电离能比氧元素的第一电离能(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是 .
(4)A、C、E三种元素可形成[E(CA3)4]2+ , 其中存在的化学键类型有(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl﹣取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为 , 若该晶体的密度为a gcm﹣3 , 则该晶胞的体积是cm3(写出表达式即可). 
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,部分元素在周期表中的位置关系如右图所示.其中X是周期表中原子半径最小的元素,Q与X同主族;Z的最外层电子数是次外层的3倍.
Y | Z | ||
R |
请回答下列问题:
(1)写出Y元素的名称:________,Q的原子结构示意图________;R在周期表中的位置为________.
(2)Q2Z电子式为:________,Q2Z2含的化学键类型为:________.
(3)R、Z分别形成简单离子的半径大小:________________(离子符号表示)
(4)Y的氢化物与其最高价氧化物对应的水化物反应的化学方程式为:__________________________.