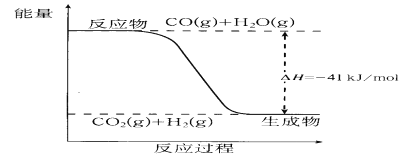
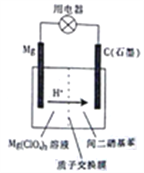
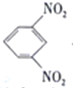
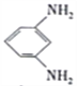
题目内容
【题目】实验室制Cl2的反应为:MnO2+4HC1(浓) ![]() MnCl2+Cl2+2H2O,下列有关该反应的说法正确的是( )
MnCl2+Cl2+2H2O,下列有关该反应的说法正确的是( )
A.MnO2是还原剂
B.HCl被氧化
C.MnO2发生氧化反应
D.4molHCl参加反应则转移4mol电子
【答案】B
【解析】解:A.Mn元素化合价降低,MnO2是氧化剂,故A错误;
B.Cl元素化合价升高,被氧化,故B正确;
C.Mn元素化合价降低,被还原,MnO2发生还原反应,故C错误;
D.Cl元素化合价由﹣1价升高到0价,则反应消耗4molHCl生成1 mol Cl2时有2 mol电子转移,故D错误.
故选B.
反应MnO2+4HCl(浓) ![]() MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,结合电子转移相等解答.
MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,结合电子转移相等解答.

 阅读快车系列答案
阅读快车系列答案【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,部分元素在周期表中的位置关系如右图所示.其中X是周期表中原子半径最小的元素,Q与X同主族;Z的最外层电子数是次外层的3倍.
Y | Z | ||
R |
请回答下列问题:
(1)写出Y元素的名称:________,Q的原子结构示意图________;R在周期表中的位置为________.
(2)Q2Z电子式为:________,Q2Z2含的化学键类型为:________.
(3)R、Z分别形成简单离子的半径大小:________________(离子符号表示)
(4)Y的氢化物与其最高价氧化物对应的水化物反应的化学方程式为:__________________________.
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH 和相关物质的溶解性如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(1)调节pH 步骤中,溶液pH的调节范围是________。
(2)滤渣1和滤渣3 主要成分的化学式分别是________、________。
(3)写出氧化步骤中加入H2O2 发生反应的离子方程式________。
(4)酸浸过程中,1molNiS失去6 NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式________。
(5)沉镍过程中,若c(Ni2+)=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为________g。(保留小数点后1位有效数字)
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为________。

【题目】自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯。下列A、B、C、D是中学常见的混合物分离或提纯的装置。
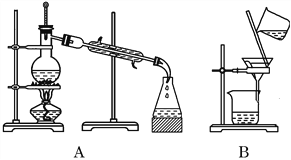
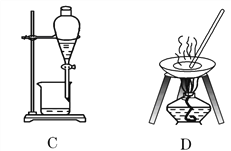
I.请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D 填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙______________________;
(2)氯化钠溶液中分离出氯化钠____________________;
(3)分离植物油和水____________________;
(4)分离酒精和水____________________;
(5)氯化钠溶液中分离出水____________________。
II.碘水中提取碘单质的方法如下:
(1)萃取分液
①下列可作为碘水中提取碘单质萃取剂的有__________
A.酒精 B.苯
②分液漏斗在使用前必须先________________;
③查资料得知:ρ(H2O)>ρ(苯)>ρ(酒精),若用①中所选萃取剂萃取碘水中的碘单质,分液时,水层应由分液漏斗的_______端口放出,有机层应由分液漏斗的________端口放出(此问填“上”或者“下”) ;
(2)蒸馏
①冷凝装置中冷凝水应该_______口进(填“上”或“下”)
②已知碘和四氯化碳的熔沸点数据如下表
熔点 | 沸点 | |
碘 | 113.7℃ | 184.3℃ |
四氯化碳 | -22.6℃ | 76.8℃ |
若用蒸馏法分离碘和四氯化碳的混合物,锥形瓶中先收集到的物质的名称是_________。