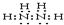题目内容
1.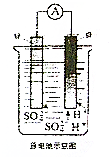 如图所示,将铜片、锌片用导线连接后置于同一稀硫酸中形成原电池,下列相关叙述正确的是( )
如图所示,将铜片、锌片用导线连接后置于同一稀硫酸中形成原电池,下列相关叙述正确的是( )| A. | 锌片是原电池负极 | B. | 溶液逐渐变为蓝色 | ||
| C. | H+在负极得到电子被还原 | D. | 锌片越纯,锌片上产生的气泡越多 |
分析 把锌片和铜片用导线相连后插入稀硫酸构成原电池,锌做负极发生氧化反应,铜做正极,溶液中氢离子在铜片上得到电子发生还原反应,以此解答.
解答 解:A.锌比铜活泼,为原电池的负极,故A正确;
B.原电池反应是锌和稀硫酸反应生成硫酸锌和氢气,无铜离子生成,则溶液不变蓝,故B错误;
C.H+在正极得到电子被还原,故C错误;
D.锌片越纯,锌片上产生的气泡越少,如为纯锌,则只在正极上析出气体,故D错误.
故选A.
点评 本题考查原电池和电解池知识,为高考常见题型,侧重于学生的分析能力的考查,注意把握原电池和电解池的工作原理,把握电极方程式的书写,难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
12.现代生活中,人们出行的代步工具多种多样,消耗的能量类型各不相同.自行车、电动自行车、普通汽车消耗的能量类型分别是①生物质能②核能③电能④太阳能⑤化学能( )
| A. | ①④⑤ | B. | ①③⑤ | C. | ①②③ | D. | ①③④ |
6.下列除杂过程中,选用试剂和方法正确的是( )
| A. | 除去乙烷中混有的乙烯,加氯气光照 | |
| B. | 除去乙烯中混有的水蒸气,通过盛有浓硫酸的洗气瓶 | |
| C. | 除去乙烷中混有水蒸气,通过碱石灰的干燥管 | |
| D. | 除去乙烯中混有的少量SO2,通过KMnO4酸性溶液后再干燥 |
13.下列说法正确的是( )
| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4 比H2SiO3 的酸性强 | |
| C. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保存水果 |
10.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 每摩尔-CH3中含10NA个电子 | |
| B. | 每摩尔CnH2n+2中,碳原子与碳原子形成的共用电子对数目为nNA | |
| C. | 14g乙烯和丙烯的混合气体中含有H原子数为2NA | |
| D. | 每摩尔苯中含有的碳氢单键的数目为6NA |
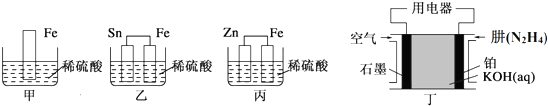
 .
.