题目内容
5.某无色溶液中,有可能存在的离子如下:K+,Ag+,Mg2+,Al3+,AlO2-,SiO32-,SO32-,SO42-,现取该溶液进行有关实验,实验结果如图所示: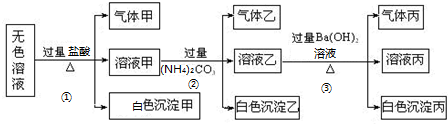
请回答下列问题:
(1)白色沉淀甲、乙分别是H2SiO3、Al(OH)3,气体乙、丙分别是CO2、NH3(都有化学式表示).
(2)生成沉淀甲的离子方程式为SiO32-+2H+=H2SiO3↓,生成沉淀乙的离子方程式为2Al3++3H2O+3CO32-═2Al(OH)3↓+3CO2↑.
(3)验证溶液中含有NH+的方法是取少量的溶液于试管中,滴加过量浓NaOH溶液并微热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含NH4+.
(4)该无色溶液中一定含有的离子为AlO2-、SiO32-、SO32-、K+,一定不含的离子有Ag+、Mg2+、Al3+.
分析 无色溶液中加入过量盐酸后生成气体甲、溶液甲和白色沉淀甲,气体甲为二氧化硫气体,则原溶液中一定含有SO32-,则一定不存在Ag+、Mg2+、Al3+;生成的白色沉淀只能为H2SiO3;溶液甲中含有过量的盐酸,溶液甲中加入过量碳酸铵后生成气体乙、溶液乙和白色沉淀乙,气体乙为二氧化碳气体,白色沉淀乙为氢氧化铝沉淀,原溶液中一定含有AlO2-;溶液乙中含有碳酸根离子、铵根离子,向溶液乙中加入过量的氢氧化钡溶液后加热,产生气体丙、溶液丙和白色沉淀丙,则气体丙为氨气、白色沉淀丙可能为硫酸钡或碳酸钡;根据分析可知,溶液中一定含有:AlO2-、SiO32-、SO32-,根据溶液电中性可知,一定还含有K+;一定不含Ag+,Mg2+,Al3+,可能含有SO42-,据此进行解答.
解答 解:无色溶液中加入过量盐酸后生成气体甲、溶液甲和白色沉淀甲,气体甲为二氧化硫气体,则原溶液中一定含有SO32-,则一定不存在Ag+、Mg2+、Al3+;生成的白色沉淀只能为H2SiO3;溶液甲中含有过量的盐酸,溶液甲中加入过量碳酸铵后生成气体乙、溶液乙和白色沉淀乙,气体乙为二氧化碳气体,白色沉淀乙为氢氧化铝沉淀,原溶液中一定含有AlO2-;溶液乙中含有碳酸根离子、铵根离子,向溶液乙中加入过量的氢氧化钡溶液后加热,产生气体丙、溶液丙和白色沉淀丙,则气体丙为氨气、白色沉淀丙可能为硫酸钡或碳酸钡,
(1)白色沉淀甲为H2SiO3,白色沉淀乙为Al(OH)3,气体乙为CO2,气体丙为NH3,
故答案为:H2SiO3;Al(OH)3;CO2;NH3;
(2)沉淀甲为硅酸,硅酸根离子与氢离子反应生成硅酸沉淀,反应的离子方程式为:SiO32-+2H+=H2SiO3↓;沉淀乙为氢氧化铝沉淀,为碳酸根离子与铝离子发生双水解反应生成的,反应的离子方程式为:2Al3++3H2O+3CO32-═2Al(OH)3↓+3CO2↑,
故答案为:SiO32-+2H+=H2SiO3↓;2Al3++3H2O+3CO32-═2Al(OH)3↓+3CO2↑;
(3)检验铵根离子的操作为:取少量的溶液于试管中,滴加过量浓NaOH溶液并微热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含NH4+,
故答案为:取少量的溶液于试管中,滴加过量浓NaOH溶液并微热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含NH4+;
(4)根据分析可知,溶液中一定含有:AlO2-、SiO32-、SO32-,根据溶液电中性可知,一定还含有K+;一定不含Ag+、Mg2+、Al3+,可能含有SO42-,
故答案为:AlO2-、SiO32-、SO32-、K+;Ag+、Mg2+、Al3+.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质及检验方法为解答关键,试题侧重基础知识的考查,培养了学生的分析、理解能力及逻辑推理能力.

| A. | SO2、NO、CO、烟尘 | B. | CO2、Cl2、N2、酸雨 | C. | HCl、SO2、N2、粉尘 | D. | CO2、NO、NH3、雾 |
| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4 比H2SiO3 的酸性强 | |
| C. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保存水果 |
| A. | 常温常压下,16g O2和32g O3的混合物中,含有O原子数目为3NA | |
| B. | 标准状态下,1mol Na2O和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1mol NaHSO4溶于水或受热熔化,电离出来的离子数目均为2NA | |
| D. | 在K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O中,若生成71g Cl2,转移的电子数目为$\frac{5}{3}$NA |
| A. | 每摩尔-CH3中含10NA个电子 | |
| B. | 每摩尔CnH2n+2中,碳原子与碳原子形成的共用电子对数目为nNA | |
| C. | 14g乙烯和丙烯的混合气体中含有H原子数为2NA | |
| D. | 每摩尔苯中含有的碳氢单键的数目为6NA |
| A. | 只含极性键的共价化合物 | |
| B. | 含非极性键的共价化合物 | |
| C. | 阴阳离子个数之比为1:1的离子化合物 | |
| D. | 可形成双核离子或者四核离子 |
| A. | 用聚氯乙烯塑料袋包装食品 | |
| B. | 在食用盐中添加适量的碘酸钾 | |
| C. | 在食品加工中科学使用食品添加剂 | |
| D. | 研发高效低毒的农药,降低蔬菜的农药残留量 |
 ;
;