题目内容
16.下列说法正确的是( )| A. | 用H2O2分解制氧气,消耗1mol H2O2,转移电子为2 mol | |
| B. | 0.5mol H2和0.5 molO2的混合气体为22.4 L | |
| C. | 16g O2和O3的混合气体中含有氧原子数目为NA | |
| D. | 在反应MnO2+4HCl═MnCl2+Cl2↑+2H2O中,每生成1mol Cl2有4mol HCl被氧化 |
分析 A、用H2O2分解制氧气,过氧化氢自身的氧化还原反应,1mol H2O2,转移1mol的电子,所以消耗1mol H2O2,转移电子为1mol;
B、状况不知,无法使用气体摩尔体积;
C、O2和O3都是由氧原子构成,也就是16g的氧原子;
D、在反应MnO2+4HCl═MnCl2+Cl2↑+2H2O中浓盐酸起酸性和强还原性,量之比为1:1.
解答 解:A、用H2O2分解制氧气,过氧化氢自身的氧化还原反应,1mol H2O2,转移1mol的电子,所以消耗1mol H2O2,转移电子为1mol,故A错误;
B、状况不知,无法使用气体摩尔体积,故B错误;
C、O2和O3都是由氧原子构成,也就是16g的氧原子的物质的量为1mol,所以16gO2和O3的混合气体中含有O数目为NA,故C正确;
D、在反应MnO2+4HCl═MnCl2+Cl2↑+2H2O中浓盐酸起酸性和强还原性,量之比为1:1,所以每生成1molCl2有2molHCl被氧化,故D错误;
故选C.
点评 本题考查氧化还原反应中电子转移的数目和阿伏加德罗常数的考查,题目难度中等.

练习册系列答案
相关题目
6.苹果酸的结构简式为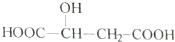 ,下列说法中不正确的是( )
,下列说法中不正确的是( )
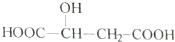 ,下列说法中不正确的是( )
,下列说法中不正确的是( )| A. | 苹果酸中能发生酯化反应的官能团有2种 | |
| B. | 1mol苹果酸可与2molNaOH发生中和反应 | |
| C. | 苹果酸可以发生消去反应,生成的有机物存在顺反异构体 | |
| D. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
7.如果a克氨气由b个原子构成,则在2a克硫化氢中含有的分子数为( )
| A. | 0.25b | B. | 0.5b | C. | 2b | D. | 4b |
4.下列材料的特性及用途叙述不正确的是( )
| A. | 氧化铝陶瓷具有两性,可用来制造人造牙齿 | |
| B. | 氮化硅陶瓷耐高温且不易传热,可用来制造柴油机 | |
| C. | 光导纤维传导光的性能很强,是非常好的通讯材料 | |
| D. | 人造刚玉硬度高,用于制造刚玉球磨机 |
11.等浓度的下列稀溶液:①乙酸 ②盐酸 ③碳酸 ④硫酸,它们的pH由小到大排列正确的是( )
| A. | ①②③④ | B. | ③①②④ | C. | ④②③① | D. | ④②①③ |
1.合理使用药物有利于身心健康.下列有关说法不正确的是( )
| A. | 氢氧化铝用于治疗胃酸过多 | |
| B. | 阿司匹林常用于解热镇痛 | |
| C. | 青霉素是一种常用的抗生素 | |
| D. | 非处方药都无毒副作用、可长期大量服用 |
8.人体内最重要的供能物质是( )
| A. | 葡萄糖 | B. | 纤维素 | C. | 油脂 | D. | 蛋白质 |
5.某同学在实验室中进行如下实验:
以下结论不正确的是( )
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 |  |  | 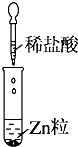 |
| 现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A. | Ⅰ中无明显变化,说明两溶液不反应 | |
| B. | Ⅱ中的白色沉淀为BaSO4 | |
| C. | Ⅲ中的离子方程式为2H++Zn═Zn2++H2↑ | |
| D. | Ⅲ中发生的反应也是氧化还原反应 |
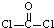 ,分子构型为平面三角形
,分子构型为平面三角形