题目内容
11.雷雨天闪电时空气中有臭氧(O3)生成,下列说法正确的是( )| A. | O2和O3互为同位素 | B. | O2和O3的相互转化是化学变化 | ||
| C. | O3是由3个氧原子构成的化合物 | D. | 等质量O2和O3含有的质子数不相同 |
分析 A.有相同质子数,不同中子数的原子互为同位素,相同元素组成,不同形态的单质互为同素异形体;
B.有新物质生成的变化属于化学变化;
C.O3为单质;
D.等物质的量的氧气和臭氧,其分子数相等,再根据氧气分子构成判断;
解答 解:A.O2和O3都是由氧元素形成的不同单质,故互为同素异形体,故A错误;
B.O2和O3为不同的物质,O2 和O3的相互转化过程中有新物质生成,属于化学变化,故B正确;
C.O3为同种元素构成的纯净物,为单质,故C错误;
D.O2和O3都由O原子构成,则等物质的量的氧气和臭氧其质子数相同,故D错误;
故选B.
点评 本题以臭氧为载体考查了基本概念、分子的构成、物质的性质以及阿伏伽德罗定律的应用,根据同位素和同素异形体的概念、化学变化的特征、臭氧的性质等知识点来分析解答即可,注意:同位素、同素异形体、同分异构体的区别,题目难度不大.

练习册系列答案
相关题目
1.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| B. | 1L0.1mol•L-1的氨水中含有0.1NA个NH4+ | |
| C. | 1molNa被完全氧化生成Na2O2,失去2NA个电子 | |
| D. | 常温常压下,8gO2含有4NA个电子 |
2.下列判断正确的是( )
| A. | 可用催化氢化法除去甲烷中的少量乙烯 | |
| B. | 苯与液溴反应,苯与H2反应属于同一类型的反应 | |
| C. | 苯不能使KMnO4溶液褪色,所以苯不能发生氧化反应 | |
| D. | 丙炔可以发生取代反应,加成反应、加聚反应 |
19.某一元脂肪羧酸1mol,可以与1mol溴发生加成反应,0.1mol该羧酸充分燃烧生成水1.7mol,则该羧酸的分子式是( )
| A. | C18H36O2 | B. | C16H34O2 | C. | C18H34O2 | D. | C16H30O2 |
6.X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
请回答下列问题:
(1)W位于周期表中第三周期,第ⅦA族.
(2)X和氢可以构成+1价阳离子,其电子式是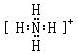 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
(3)X的最高价氧化物的水化物与其氢化物能化合生成M,M的水溶液显酸性的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)①Y和Z可组成一种气态化合物Q,Q能与W的单质在潮湿环境中反应,反应的化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4.
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应时,每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
| X | Y | |
| Z | W |
(1)W位于周期表中第三周期,第ⅦA族.
(2)X和氢可以构成+1价阳离子,其电子式是
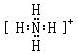 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).(3)X的最高价氧化物的水化物与其氢化物能化合生成M,M的水溶液显酸性的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)①Y和Z可组成一种气态化合物Q,Q能与W的单质在潮湿环境中反应,反应的化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4.
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应时,每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
16.下列说法正确的是( )
| A. | NA个H2SO4分子的总质量就是H2SO4的摩尔质量 | |
| B. | 将40 g烧碱溶于水得溶液甲,再向甲中通入1 mol HCl得溶液乙(假设过程中溶液体积不变),则在相同温度下,甲和乙的导电能力一样 | |
| C. | 1 L 0.1 mol/L HF溶液中含有的离子总数约为0.2 NA | |
| D. | 标况下22.4 L SO3溶解于水并稀释为1 L后,溶液中c(H+)=2 mol/L |
3.硫代硫酸钠(Na2S2O3)俗称海波,它可看成是用一个S原子取代了Na2SO4中的一个O原子而形成.某校化学研究性学习小组运用类比学习的思想,并通过实验探究Na2S2O3的化学性质.
提出问题:Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
实验探究:取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究.
实验结论:
探究①:Na2S2O3呈碱性,能与强酸反应.探究②:具有还原性.
问题讨论:甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化.你认为该方案不正确(填“正确,”或“不正确”),理由是因氯水过量,氯水中同样含有Cl-.
提出问题:Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
实验探究:取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究.
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
| 探究① | A.用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 | a.溶液pH=8 | i.S2O32-+H2O?HS2O3-+OH- |
| B.向pH=2的硫酸中滴加Na2S2O3溶液 | b.有淡黄色沉淀(或乳白色浑浊)和无色刺激性气味气体产生 | ii.S2O32一+2H+=S↓+SO2↑ +H2O | |
| 探究② | C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | c.氯水颜色变浅 | iii.S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ |
探究①:Na2S2O3呈碱性,能与强酸反应.探究②:具有还原性.
问题讨论:甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化.你认为该方案不正确(填“正确,”或“不正确”),理由是因氯水过量,氯水中同样含有Cl-.
20.将质量相等的铁片和铜片插入氯化钠溶液中,铜片与电源的正极相连,铁片与电源的负极相连,以I=1A的恒定电流强度进行电解,下列有关说法正确的是( )
| A. | 阳极上产生能够使湿润淀粉碘化钾试纸变蓝的气体 | |
| B. | 电解一段时间后,电解池的温度升高10℃,此时铁片上析出气体的速率加快 | |
| C. | 电解时钠离子向铜片电极方向移动 | |
| D. | 电解一段时间后溶液中会出现蓝色沉淀,总反应为:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2↓+H2↑ |
1. 如图是两个反应反应前后反应物总能量和生成物总能量的比较图,对于A、B两个反应的说法正确的是( )
如图是两个反应反应前后反应物总能量和生成物总能量的比较图,对于A、B两个反应的说法正确的是( )
 如图是两个反应反应前后反应物总能量和生成物总能量的比较图,对于A、B两个反应的说法正确的是( )
如图是两个反应反应前后反应物总能量和生成物总能量的比较图,对于A、B两个反应的说法正确的是( )| A. | A反应必须加热,B反应不需要加热 | |
| B. | A反应是放热反应,B反应是吸热反应 | |
| C. | A反应是吸热反应,B反应是放热反应 | |
| D. | A反应不需要加热,B反应必须加热 |