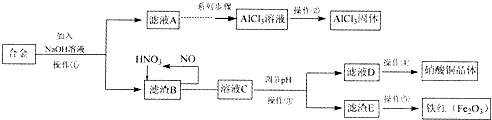
题目内容
12.亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题: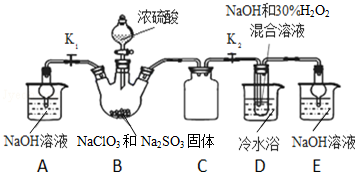
实验Ⅰ:制取NaClO2晶体按如图装置进行制取.
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
(1)装置C的作用是防止D瓶溶液倒吸到B瓶中;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的方程式为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;装置D中反应生成NaClO2的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;装置B中反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有的一种阴离子是SO42-;检验该离子的方法是取少量反应后的溶液于试管中,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤.
①减压,55℃蒸发结晶;②趁热过滤;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl;
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+4I-+4H+=2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-).请计算所称取的样品中NaClO2的物质的量为c•V•10-3mol.
分析 (1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;
(2)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平书写方程式;B制得的气体中含有SO2,在装置D中被氧化生成硫酸,可以用利用硫酸钡是白色沉淀检验硫酸根;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制;
(4)由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl;
(5)根据化学反应可得关系式:NaClO2~2I2~4S2O32-,令样品中NaClO2的物质的量x,根据关系式计算.
解答 解:(1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中,故答案为:防止D瓶溶液倒吸到B瓶中;
(2)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,反应的方程式为2NaClO3+Na2SO3+H2SO4=2 ClO2↑+2Na2SO4+H2O,装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,B制得的气体中含有SO2,在装置D中被氧化生成硫酸,溶液中可能存在SO42-,用氯化钡溶液检验SO42-,具体操作:取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-,
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;SO42-;取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
故答案为:趁热过滤;
(4)由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl,
故答案为:NaClO3和NaCl;
(5)令样品中NaClO2的物质的量x,则:
NaClO2~2I2~4S2O32-,
1mol 4mol
0.25x c mol•L-1×V×10-3L
故x=c•V•10-3mol
故答案为:c•V•10-3mol.
点评 本题考查亚氯酸钠制备实验的基本操作、亚氯酸钠的性质及中和滴定等知识,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,难度较大.

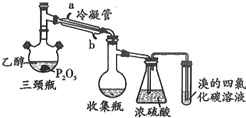 有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验.按如表所示的量和反应条件在三颈瓶中加入一定量P2O5,再注入95%的乙醇,并加热,观察现象.
有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验.按如表所示的量和反应条件在三颈瓶中加入一定量P2O5,再注入95%的乙醇,并加热,观察现象.| 实验 | P2O5/g | 95%乙醇量/mL | 加热方式 |
| 实验1 | 2 | 4 | 酒精灯 |
| 实验2 | 2 | 4 | 水浴70℃ |
| 实验 | 实验现象 | ||
| 三颈瓶 | 收集瓶 | 试管 | |
| 实验1 | 酒精加入时,立刻产生白雾,当用酒精灯加热时,有气泡产生,并逐渐沸腾,生成黏稠状液体 | 有无色液体 | 溶液褪色 |
| 实验2 | 酒精加入时,立刻产生白雾,当用水浴加热时,不产生气泡,一段时间后,反应瓶内生成黏稠状液体 | 有无色液体 | 溶液不褪色 |
写出实验室用乙醇制乙烯的化学方程式:CH3-CH2-OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)如图装置中冷凝管的作用是冷凝导气
(3)实验1使溴的四氯化碳溶液褪色的物质是CH2=CH2(写结构简式)
(4)根据实验1、2可以推断:
①以P2O5作为催化剂获得乙烯的反应条件是较高温度下或直接加热
②P2O5与95%乙醇在水浴70℃加热条件下(三颈瓶、收集瓶中的液体经检验为磷酸三乙酯)可以发生的有机反应的类型是酯化 反应.
 醇脱水是合成烯烃的常用方法,实验室合成环已烯的反应和实验装置(夹持装置已略去)如下可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环已烯的反应和实验装置(夹持装置已略去)如下可能用到的有关数据如下:| 相对分子质量 | 密度(g•cm-3) | 沸点(℃) | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O,在a中加入20g环已醇和2小片碎片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
+H2O,在a中加入20g环已醇和2小片碎片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环已烯10g.
回答下列问题:
(1)装置b的名称是冷凝管.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案称号).
A.立即补加B.冷却后补加C.不需补加D.重新配料
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.