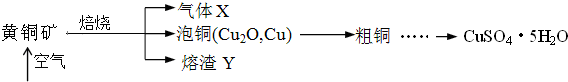题目内容
20.某研究小组在实验室中将工厂废弃的合金,经过一系列的反应,制得氯化铝固体、硝酸铜晶体和铁红.其实验方案如下: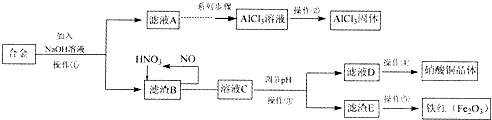
(1)该小组所用的合金中含有的金属为铁、铜、铝(填名称).
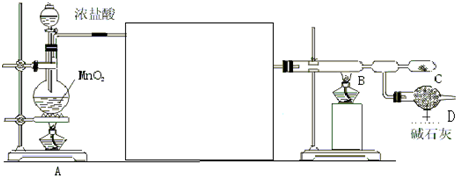
(2)操作①、③使用的主要玻璃仪器是漏斗、烧杯、玻璃棒,简述操作②的方法:在HCl气流中蒸干水分.操作④实验操作步骤包括:加热浓缩、冷却结晶、过滤(填操作名称)、洗涤、干燥.
(3)写出滤渣B中较活泼金属与足量稀HN03后发生反应的离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O、4H++NO3-+Fe=Fe3++NO↑+2H2O;
(4)若该小组通过上述实验流程制得铁红80g,假设实验过程中无质量损失,则合金中铁的质量为56g;
(5)上述实验流程中符合“绿色化学”理念的做法是废物利用,利用工厂废弃物;反应产生的NO循环利用,避免污染(答出一点即可).
分析 根据金属的性质结合框图转化关系和所得产品可知:合金加入氢氧化钠,滤液A→AlCl3,铝既与酸反应又与碱反应,金属铝和氢氧化钠反应,加入NaOH溶液后金属铝溶解生成偏铝酸钠溶液,金属铁和金属铜不与氢氧化钠反应,滤液A中含有偏铝酸钠,滤渣B为铁、铜,铜和铁与稀硝酸能发生反应生成硝酸盐和一氧化氮、水,一氧化氮、水、氧气反应生成硝酸再循环利用,溶液C通过调节pH可以使Fe3+沉淀完全,滤渣E为氢氧化铁,滤液D为硝酸铜溶液,用加热浓缩、冷却结晶、过滤、洗涤、干燥的方法得到硝酸铜晶体,灼烧氢氧化铁得到铁红.
(1)废弃的合金,经过一系列的反应,制得氯化铝固体、硝酸铜晶体和铁红,说明合金中含有的金属为铁、铜、铝;
(2)操作①、③为过滤操作,根据过滤操作的要求分析使用的主要玻璃仪器;氯化铝为强酸弱碱盐,易水解,需在HCl气流中蒸干水分,滤液D为硝酸铜溶液,用加热浓缩、冷却结晶、过滤、洗涤、干燥的方法,得到硝酸铜晶体;
(3)滤渣B为铁、铜,铜和铁与稀硝酸能发生反应生成硝酸盐和一氧化氮、水;
(4)根据元素守恒,合金中铁的质量等于氧化铁中铁元素的质量;
(5)废弃的合金制得氯化铝固体、硝酸铜晶体和铁红为废物利用,反应产生的NO循环利用,避免污染.
解答 解:(1)根据实验方案流程,废弃的合金,经过一系列的反应,制得氯化铝固体、硝酸铜晶体和铁红,说明合金中含有的金属为铁、铜、铝,
故答案为:铜;铝;
(2)合金加入氢氧化钠,金属铝和氢氧化钠反应,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,生成氢气和易溶于水的偏铝酸钠,金属铁和金属铜不与氢氧化钠反应,操作①为过滤操作,滤渣B为铁、铜,铜和铁与稀硝酸能发生反应生成硝酸盐和一氧化氮、水,一氧化氮、水、氧气反应生成硝酸再循环利用,溶液C通过调节pH可以使Fe3+沉淀完全,滤渣E为氢氧化铁,操作③为过滤操作,操作①、③都为过滤操作,过滤时需要制作过滤器的漏斗、固定仪器的铁架台、引流用的玻璃棒、承接滤液的烧杯,主要玻璃仪器是漏斗、烧杯、玻璃棒,氯化铝为强酸弱碱盐,Al3+易水解,水解生成H+,水解的离子方程式为Al3++3H2O?Al(OH)3+3H+,所以需在HCl气流中蒸干水分,操作④获得硝酸铜晶体,用加热浓缩、冷却结晶、过滤、洗涤、干燥的方法得到,
故答案为:漏斗、烧杯、玻璃棒;在HCl气流中蒸干水分;过滤;
(3)铜和铁与稀硝酸能发生反应生成硝酸盐和一氧化氮、水,反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O、4H++NO3-+Fe=Fe3++NO↑+2H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O、4H++NO3-+Fe=Fe3++NO↑+2H2O;
(4)铁红中铁元素的质量等于原合金中铁的质量,设合金中铁的质量为m
Fe2O3~2Fe
160 56×2
80g m
解得:m=56g,
故答案为:56;
(5)将工厂废弃的合金,经过一系列的反应,制得氯化铝固体、硝酸铜晶体和铁红,为废物利用,利用工厂废弃物,铜和铁与稀硝酸能发生反应生成硝酸盐和一氧化氮、水,一氧化氮、水、氧气反应生成硝酸再循环利用,避免污染,
故答案为:废物利用,利用工厂废弃物;反应产生的NO循环利用,避免污染.
点评 本题考查废弃的合金制取氯化铝固体、硝酸铜晶体和铁红的实验,主要考查的是离子反应方程式的书写,物质的分离和提纯等,综合性较强,要注意从框图转化中找出有用信息,题目难度中等.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案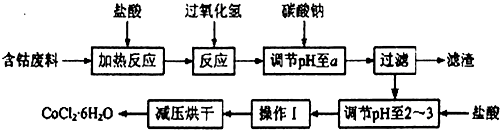
已知:
①CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)钴与盐酸反应的化学方程式为Co+2HCl=CoCl2+H2↑.
(2)流程中加入碳酸钠调节pH至a,a的范围是5.2~7.6;滤渣中含有的Al(OH)3是良好的阻燃剂,其原理是Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的Al2O3覆盖在可燃物表面,阻燃效果更佳;加盐酸调节pH至2~3的目的是抑制Co2+的水解,防止在后续的操作中形成Co(OH)2杂质.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将119g样品溶于水形成100ml溶液,取25mL于烧杯中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称得质量为28.7g,计算产品中CoCl2•6H2O含量为80%.(已知:CoCl2•6H2O化学式量为238,AgCl为143.5,)
| A. | 有Fe3+大量存在的溶液中:Na+、Cl-、K+、SCN- | |
| B. | 滴加酚酞显红色的溶液中:NH4+、Al3+、SO42-、NO3- | |
| C. | 常温下pH=1的溶液中:Na+、K+、Cl-、S2O32- | |
| D. | 有CO32-存在的无色透明溶液中:Na+、K+、Cl-、AlO2- |
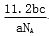 L B.
L B.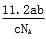 L
L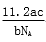 L D.
L D. L
L