题目内容
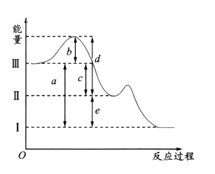
【题目】反应H2(g)+Cl2(g)═2HCl(g) 的发生过程能量变化如下所示:
![]()
下列说法错误的是
A.H﹣H键比Cl﹣Cl键稳定
B.△H=﹣184.5 kJmol﹣1
C.正反应活化能比逆反应活化能高
D.在相同条件下,1mol H2(g)和1mol Cl2(g)分别在点燃和光照条件下反应生成2mol HCl(g),重新恢复到原来的状态时△H相同
【答案】C
【解析】
试题分析:A、H—H键的键能比Cl—Cl键的键能大,所以H—H键比Cl—Cl键稳定,A正确;B、△H=反应物键能之和-生成物键能之和=436.4KJ/mol+242.7KJ/mol-2×431.8KJ/mol=-184.5KJ/mol,B正确;C、该反应是放热反应,活化能是断键吸收的能量,所以正反应活化能比逆反应活化能低,C错误;D、反应热只与始态和终态有关,与反应途径无关,所以点燃和光照条件下ΔH相同,D正确。答案选C。

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目