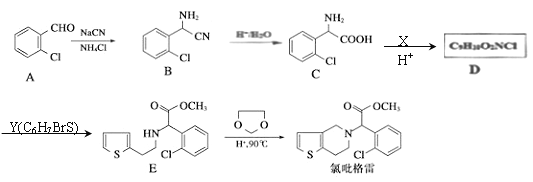
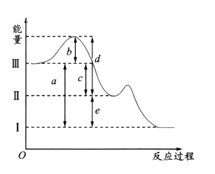
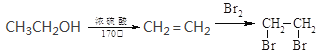��Ŀ����
����Ŀ��W��X��Y��Z��Ϊ����������Ԫ�أ���ԭ����������������֪WԪ�ص�ԭ���γɵ�������һ�����ӣ�X��Y��Ԫ�����ڱ��д������ڵ�λ�ã����ǵĵ����ڳ����¾�Ϊ��ɫ���壻ZΪͬ������ԭ�Ӱ뾶����Ԫ�ء������й�˵����ȷ����
A. ����Ԫ�ؾ�Ϊ�ǽ���Ԫ��
B. W��X��Y�γɵ�����ӵķе㣺X>Y
C. Y��Z�γɵĻ�������ֻ�����Ӽ�
D. W��Y��Z�γɵĻ�����ĵ���ʽΪ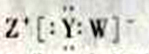
���𰸡�D
��������WԪ�ص�ԭ���γɵ�������һ�����ӣ���WΪH������Ԫ��ԭ��������������ZΪͬ������ԭ�Ӱ뾶����Ԫ�أ���ZΪNa��X��Y��Ԫ�����ڱ��д������ڵ�λ�ã��䵥���ڳ�����Ϊ��ɫ���壬��XΪN��YΪO����A����������������ZΪNa�����ڽ���Ԫ�أ��ʴ���B����XΪN��YΪO�����⻯����NH3��H2O��H2O�ķе����NH3���ʴ���C��YΪO���γɵĻ�������Na2O��Na2O2��Na2Oֻ�����Ӽ���Na2O2�������Ӽ��ͷǼ��Թ��ۼ����ʴ���D���γɻ�������NaOH���������ӻ���������ʽΪ��![]() ������ȷ��
������ȷ��

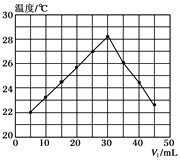
����Ŀ���±����������У�����֮�䲻����ʵ����ͼ![]() ��ʾת�����ǣ� ��
��ʾת�����ǣ� ��
ѡ�� | X | Y | Z | M |
A | Fe��s�� | FeCl2 | FeCl3 | Cl2 |
B | NaOH��aq�� | Na2CO3 | NaHCO3 | CO2 |
C | NH3��g�� | NO | NO2 | O2 |
D | S��s�� | SO2 | SO3 | O2 |
A. A B. B C. C D. D