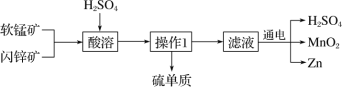
题目内容
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为 101℃,易溶于水,受热易脱水、升华,170℃以上分解。 常温下它的电离常数 K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)查阅资料知:草酸晶体 175℃分解成 CO2、CO、H2O,请写出草酸晶体分解的化学反应方程 式:_____。
(2)请用下列的装置(图中加热装置已略去)分解草酸晶体以制备少量 CO 气体,最佳的连接顺序 为:_____。(填字母序号)
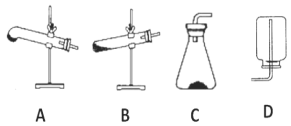
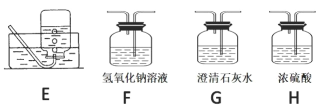
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有_____(填序号)。
A.室温下,测 0.1mol/L 的 H2C2O4 溶液与 H2SO4 溶液的 pH,硫酸溶液的 pH 比草酸的小;
B.室温下,取 pH=3 的 H2C2O4 溶液稀释 100 倍后,测其 pH<5;
C.标况下,取 0.10mol/L 的 H2C2O4 溶液 100mL 与足量锌粉反应,收集到 H2 体积为 224mL。
(4)现需要配制 900mL1mol/L 的草酸溶液。
①需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、________ 、_________ (填仪 器名称)。
②下列操作会使所配溶液浓度偏低的是_____。(填字母)
A.称量时用了生锈的砝码
B.容量瓶未干燥即用来配制溶液
C.H2C2O4·2H2O 晶体失去了部分结晶水
D.定容时,仰视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
(5)用草酸滴定 KMnO4 溶液的方法可测定 KMnO4 粗品的纯度(质量分数)。
①滴定过程中反应的离子方程式为_____。
②量取 KMnO4 样品溶液应选用_________ (填“酸式”或“碱式”)滴定管;若量取 KMnO4 样品溶液的 滴定管用蒸馏水洗净后未润洗,则最终的测定结果将_______(填“偏大”、“偏小”或“不变”)。
③现取 KMnO4 粗品 10g,配成 100mL 溶液,取 25.0 mL 用(4)中配制的草酸溶液滴定,并进行 3 次 平行实验,所用的草酸溶液的体积分别为 23.00 mL、20.02 mL、19.98 mL,请问 KMnO4 粗品的质量分数 为_____________。(已知:KMnO4 的摩尔质量为 158g/mol)
【答案】H2C2O4+2H2O = CO↑+CO2↑ +3H2O↑A-F-G-EAB玻璃棒1000mL 容量瓶DE2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O酸式偏小50.56%
【解析】
(1)草酸晶体的受热分解生成CO、CO2、水,根据得失电子守恒,CO、CO2的比为1:1,方程式是H2C2O4·2H2O![]() CO↑+CO2↑ +3H2O↑;故答案为:H2C2O4·2H2O
CO↑+CO2↑ +3H2O↑;故答案为:H2C2O4·2H2O![]() CO↑+CO2↑ +3H2O↑;
CO↑+CO2↑ +3H2O↑;
(2)给试管里的晶体加热时,为防止反应生成的水或所含结晶水在管口液化后倒流引起试管破裂,要求试管口要向下倾斜,又因为试管底下垂,可防止草酸晶体熔化后从试管流出,则加热装置选择A;为制备分解产物中的CO,先要排除已证明生成的CO2对实验的干扰,可用F装置吸收CO2气体,并利用G装置证明CO2已经除尽,最后用排水法收集CO,所以最佳的连接顺序为A-F-G-E;故答案为:A-F-G-E;
(3)A.室温下,测0.1mol/L的H2C2O4溶液与H2SO4溶液的pH,硫酸溶液的pH比草酸的小,说明草酸溶液中存在电离平衡,证明草酸是弱酸,故A正确;
B.室温下,取pH=3的H2C2O4溶液稀释100倍后,测其pH<5,说明稀释促进电离,溶液中存在电离平衡,为弱酸,故B正确;
C.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL,强酸和弱酸都符合,和强酸弱酸无关,故C错误;
答案选AB;
(4) ①配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,用托盘天平称取草酸,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒2~3次,并移入容量瓶内,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,盖好瓶塞,反复颠倒摇匀;所以需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、1000mL容量瓶。故答案为:玻璃棒、1000mL 容量瓶;
②A.称量时用了生锈的砝码,草酸物质的量偏大,会使所配溶液浓度偏高; B.容量瓶未干燥即用来配制溶液,无影响; C.H2C2O4·2H2O晶体失去了部分结晶水,草酸物质的量偏大,会使所配溶液浓度偏高; D.定容时,仰视刻度线,溶液体积偏大,会使所配溶液浓度偏低; E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,溶液体积偏大,使所配溶液浓度偏低。故答案为:DE;
(5)①用草酸滴定KMnO4溶液,高锰酸根离子被还原为锰离子、草酸被氧化为二氧化碳,反应离子方程式是2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O;
②KMnO4具有氧化性,能腐蚀橡胶,所以量取KMnO4样品溶液应选用酸式滴定管;若量取KMnO4样品溶液的滴定管用蒸馏水洗净后未润洗,造成高锰酸钾的物质的量偏小,消耗草酸的的体积偏小, 根据c(待测)=![]() ,最终的测定结果将偏小;故答案为:酸式、偏小;
,最终的测定结果将偏小;故答案为:酸式、偏小;
③3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,第一次实验消耗草酸溶液的体积偏离正常误差,根据第二次、第三次实验数据消耗草酸溶液的平均体积是20.00 mL,设高锰酸钾的纯度为x%,
2MnO4- +5H2C2O4 +6H+=2Mn2+ +10CO2↑+8H2O
2 5
![]() 1mol/L
1mol/L![]() 0.02L
0.02L
x%=50.56%,故答案为:50.56%。