题目内容
【题目】MnO2 和 Zn 是制造普通干电池的重要原料,现用软锰矿(主要成分为 MnO2)和闪锌矿(主要成分为 ZnS)制备MnO2和Zn的工艺流程如下:
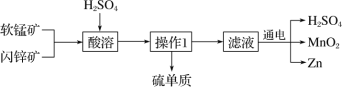
下列说法不正确的是( )
A. 酸溶时,ZnS 作还原剂 B. 原料硫酸可以循环使用
C. 操作 1 是萃取 D. 不可用盐酸代替硫酸进行酸溶
【答案】C
【解析】
根据流程图,酸溶时![]() ,硫元素化合价升高;电解过程生成的硫酸,可以供酸溶时使用;操作 1 是溶液与固体分离;氯离子能被二氧化锰氧化;
,硫元素化合价升高;电解过程生成的硫酸,可以供酸溶时使用;操作 1 是溶液与固体分离;氯离子能被二氧化锰氧化;
根据流程图,酸溶时![]() ,硫元素化合价升高,所以ZnS 作还原剂,故A正确;电解过程生成的硫酸,可以供酸溶时使用,故B正确;操作 1 是分离溶液与固体,是过滤,不是萃取,故C错误;氯离子能被二氧化锰氧化为氯气,所以不可用盐酸代替硫酸进行酸溶,故D正确。
,硫元素化合价升高,所以ZnS 作还原剂,故A正确;电解过程生成的硫酸,可以供酸溶时使用,故B正确;操作 1 是分离溶液与固体,是过滤,不是萃取,故C错误;氯离子能被二氧化锰氧化为氯气,所以不可用盐酸代替硫酸进行酸溶,故D正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
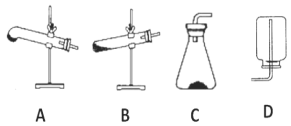
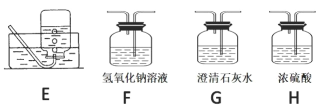
【题目】下列有关实验的选项正确的是
|
|
|
|
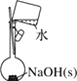
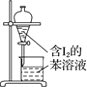
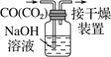
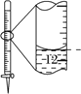
A.配制 0.10 mol·L-1NaOH溶液 | B.苯萃取碘水中I2,分出水层后的操作 | C.除去CO中的CO2 | D.记录滴定终点读数为12.20mL |
A. A B. B C. C D. D