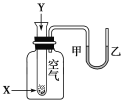
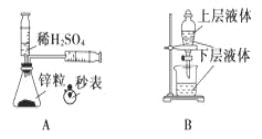
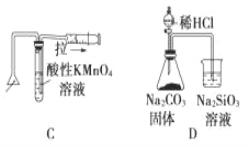
题目内容
【题目】废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备ZnSO4·7H2O和CuSO4·5H2O的部分实验步骤如下:
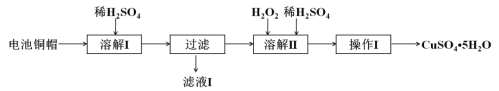
(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是___________、____________。
(2) 从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为__________、__________、过滤、冰水洗涤、低温干燥。
(3)在“溶解II”步骤中,发生反应的离子方程式为____________________________。
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol·L-1Na2S2O3溶液至刚好完全反应,消耗Na2S2O3溶液25.00mL。已知:2Cu2++4I-===2CuI(白色)↓+I2, 2S2O32-+I2===2I-+S4O62- 请依据实验数据计算样品中CuSO4·5H2O的质量分数(写出计算过程)_______________________。
【答案】加热、搅拌 将铜帽粉碎、适当提高硫酸浓度等 蒸发浓缩 冷却结晶 Cu+H2O2+2H+===Cu2++2H2O 98.43﹪
【解析】
铜和锌混合物加入硫酸,锌溶解,过滤后硫酸锌进入滤液中,过滤后的铜与过氧化氢和硫酸反应生成硫酸铜,再结晶得到硫酸铜晶体。
(1)加快溶解速率,可采取的措施是加热、搅拌或将铜帽粉碎或适当提高硫酸浓度等。
(2) 从“滤液I”中提取ZnSO4·7H2O应采用重结晶的方法,实验步骤依次为蒸发浓缩 、冷却结晶、过滤、冰水洗涤、低温干燥。
(3)在“溶解II”步骤中,铜和过氧化氢和硫酸反应生成硫酸铜和水,发生反应的离子方程式为Cu+H2O2+2H+===Cu2++2H2O。
(4)根据反应中的关系得到关系式,根据物质的量比例进行计算即可,
n(Na2S2O3) = 0.02500L ×0.02000mol·L-1 = 5.000×10-4 mol
根据关系式 2Cu2+~I2 ~ 2S2O32-
n(CuSO4)= n(Na2S2O3)= 5.000×10-4 mol
250mL溶液中n(CuSO4)=10×5.000×10-4 mol = 5.000×10-3 mol
m(CuSO4·5H2O) = 5.000×10-3 mol×250g·mol -1 = 1.250 g
样品中CuSO4·5H2O的质量分数为1.250 g ÷ 1.270 g = 0.9843 =98.43﹪

【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。肼(N2H4)与N2O4的反应为2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g) △H= -1077kJmol-1
已知相关反应的化学键键能数据如下表所示:
化学键 | N-H | N-N | N≡N | O-H |
E/(kJmol-1) | 390 | 190 | 946 | 460 |
则使1mol N2O4(g)分子中化学键完全断裂时需要吸收的能量是___________。
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。

①由图推测该反应的△H ___0(填“>”或“<”),理由为________________。
②图中a点对应温度下,已知N2O4的起始压强po为108 kPa,则该温度下反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________,在下左图上标出的点中,能表示反应达到平衡状态的点为__________(填字母代号)。

(3)电解NO2制备NH4NO3,其工作原理如图所示。

①阳极的电极反应式为________________________________________。
②为使电解产物全部转化为NH4NO3,需补充某种化合物A,则A的化学式为_________。