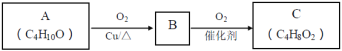
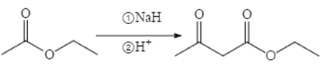
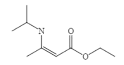
题目内容
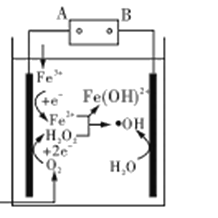
【题目】如图所示,甲、乙两U形管各盛有100mL溶液,请回答下列问题:
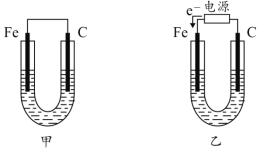
(1)若两池中均为饱和NaCl溶液:
①甲池中铁电极发生_____________腐蚀(填“析氢”或“吸氧”),碳棒上电极反应式__________________________;
②甲池铁棒腐蚀的速率比乙池铁棒_____(填“快”、“慢”或“相等”)。
(2)若乙池中盛CuSO4溶液:
①电解硫酸铜溶液的化学方程式___________________________________;
②乙池反应一段时间后,两极都产生3.36L(标况)气体,该硫酸铜溶液的浓度为___________ mol·L-1。
【答案】吸氧 O2+2H2O+4e-=4OH- 快 2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑ 1.5
2Cu+2H2SO4+O2↑ 1.5
【解析】
(1)若两池中均为饱和NaCl溶液:甲池属于原电池,铁易失电子作负极,碳作负极,正极上氧气得电子发生还原反应;乙池属于电解池,根据电子流向知,C电极为阳极,铁电极为阴极被保护,据此分析解答;
(2)①若乙池中盛CuSO4溶液,C电极为阳极,溶液中的氢氧根离子失电子发生氧化反应,铁电极为阴极,溶液中的铜离子得电子发生还原反应,据此书写电解硫酸铜溶液的化学方程式;②两极都产生3.36L(标况)气体,则阳极上始终是氢氧根离子放电,阴极首先是铜离子放电,铜离子反应完成后,再氢离子放电,根据得失电子守恒计算。
(1)①甲装置是将化学能转化为电能的装置,为原电池,铁易失电子作负极,碳作正极,在饱和NaCl溶液中,正极上氧气得电子发生还原反应,为吸氧腐蚀,正极反应式为2H2O+O2+4e-=4OH-,故答案为:吸氧;2H2O+O2+4e-=4OH-;
②甲装置是将化学能转化为电能的装置,为原电池,铁易失电子作负极,乙池属于电解池,根据电子流向知,C电极为阳极,铁电极为阴极,被保护,所以甲池铁棒腐蚀的速率比乙池铁棒快,故答案为:快;
(2)①若乙池中盛CuSO4溶液,C电极为阳极,溶液中的氢氧根离子失电子发生氧化反应,铁电极为阴极,溶液中的铜离子得电子发生还原反应,则电解硫酸铜溶液的化学方程式为:2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑,故答案为:2CuSO4+2H2O
2Cu+2H2SO4+O2↑,故答案为:2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑;
2Cu+2H2SO4+O2↑;
②3.36L(标况)气体的物质的量为![]() =0.15mol,两极都产生3.36L(标况)气体,则阳极上始终是氢氧根离子放电,电极反应式为4OH--4e-=O2↑+2H2O,生成氧气0.15mol,共失电子0.15mol×4=0.6mol;阴极首先是铜离子放电,电极反应式为Cu2++2e-=Cu,铜离子反应完成后,氢离子再放电,电极反应式为2H++2e-=H2↑,生成氢气0.15mol,得电子0.15mol×2=0.3mol,据得失电子守恒有2n(Cu2+)+0.3=0.6,n(Cu2+)=0.15mol,所以c(Cu2+)=
=0.15mol,两极都产生3.36L(标况)气体,则阳极上始终是氢氧根离子放电,电极反应式为4OH--4e-=O2↑+2H2O,生成氧气0.15mol,共失电子0.15mol×4=0.6mol;阴极首先是铜离子放电,电极反应式为Cu2++2e-=Cu,铜离子反应完成后,氢离子再放电,电极反应式为2H++2e-=H2↑,生成氢气0.15mol,得电子0.15mol×2=0.3mol,据得失电子守恒有2n(Cu2+)+0.3=0.6,n(Cu2+)=0.15mol,所以c(Cu2+)=![]() =1.5mol/L,故答案为:1.5。
=1.5mol/L,故答案为:1.5。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
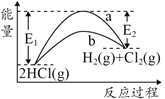
黄冈海淀全程培优测试卷系列答案【题目】HCl(g)分别在有、无催化剂的条件下分解的能量变化如图所示,下列说法正确的是
化学键 | H—H | H—Cl | Cl—Cl |
键能kJ·mol-1 | 436 | 431 | 243 |
A.由键能可得1molHCl(g)完全分解需吸收183kJ的能量
B.有催化剂的反应曲线是a曲线
C.a曲线变为b曲线,反应物的活化分子百分数增大
D.b曲线的热化学方程式为:2HCl(g)=H2(g)+Cl2(g) ΔH=-( E1-E2 )kJmol-1