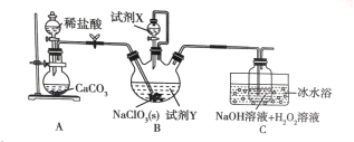
题目内容
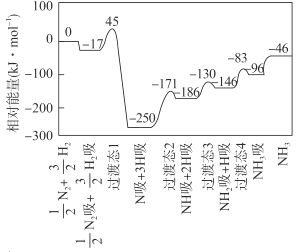
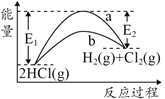
【题目】HCl(g)分别在有、无催化剂的条件下分解的能量变化如图所示,下列说法正确的是
化学键 | H—H | H—Cl | Cl—Cl |
键能kJ·mol-1 | 436 | 431 | 243 |
A.由键能可得1molHCl(g)完全分解需吸收183kJ的能量
B.有催化剂的反应曲线是a曲线
C.a曲线变为b曲线,反应物的活化分子百分数增大
D.b曲线的热化学方程式为:2HCl(g)=H2(g)+Cl2(g) ΔH=-( E1-E2 )kJmol-1
【答案】C
【解析】
A.H-Cl键能的数据为431kJmol-1,由键能可得1molHCl(g)完全分解需吸收![]() (431kJ×2-436 kJ -243 kJ)=91.5kJ的能量,故A错误;
(431kJ×2-436 kJ -243 kJ)=91.5kJ的能量,故A错误;
B.加入催化剂,可降低活化能,有催化剂的反应曲线是b曲线,故B错误;
C.a曲线变为b曲线,活化能降低,活化分子数目增大,活化分子百分数增大,故C正确;
D.HCl的分解为吸热反应,2HCl(g)═H2(g)+Cl2(g) △H=+(E1-E2)kJmol-1,故D错误;
故选C。

练习册系列答案
相关题目
【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中![]() 假设容器体积不变,固体试样体积忽略不计
假设容器体积不变,固体试样体积忽略不计![]() ,使其达到分解平衡:
,使其达到分解平衡:![]() 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
温度 |
|
|
|
|
|
平衡气体总浓度 |
|
|
|
|
|
下列有关叙述正确的是
A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B.因该反应![]() 、
、![]() ,所以在低温下自发进行
,所以在低温下自发进行
C.达到平衡后,若在恒温下压缩容器体积,体系中气体的浓度增大
D.根据表中数据,计算![]() 时的分解平衡常数约为
时的分解平衡常数约为![]()