题目内容
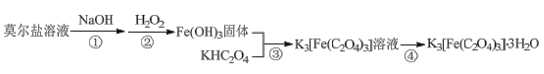
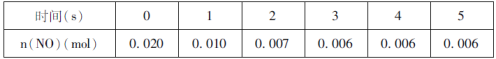
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
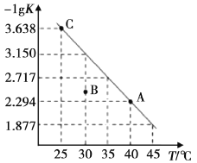
A.C点对应状态的平衡常数K(C)=10-3.638
B.该反应的ΔH>0
C.NH3的体积分数不变时,该反应一定达到平衡状态
D.30℃时,B点对应状态的v(正)<v(逆)
【答案】C
【解析】
根据题目可知,反应温度升高,平衡常数增大,故反应是吸热反应。
A. C点指的是该温度下平衡常数的负对数(-lgK),对应状态的平衡常数K(C)=10-3.638,A正确;
B. 该反应为吸热反应,ΔH>0,B正确;
C. 反应物为固体,无论是否达到平衡状态,NH3的体积分数均不变时,C错误;
D. 30℃时,B点的物质浓度熵大于平衡常数,即反应向着逆反应反应方向移动,对应状态的v(正)<v(逆),D正确。
答案为C。

练习册系列答案
相关题目