题目内容
【题目】高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) →Fe(s)+CO2(g)-Q,已知1100℃时,K=0.263
(1)写出该反应的平衡常数表达式____。温度升高,化学平衡移动后达到新的平衡,高炉中CO2和CO的体积比值___,平衡常数K值___(以上选填“增大”、“减小”或“不变”)。
(2)1100℃时测得高炉中c(CO2)=0025mol/L、c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态___(选填“是”或“否”),此时,化学反应速率是v正___v逆(选填“大于”、“小于”或“等于”),其原因是_____。
【答案】K=![]() 增大 增大 否 大于 因温度不变,K值不变,
增大 增大 否 大于 因温度不变,K值不变,![]() <0.263,未达到平衡状态,为增大
<0.263,未达到平衡状态,为增大![]() 的值反应正向进行,故v正>v逆。
的值反应正向进行,故v正>v逆。
【解析】
(1)依据平衡常数的概念书写;升高温度平衡向吸热方向移动,根据平衡移动的方向判断平衡常数K值;
(2)依据浓度计算浓度商结合平衡常数进行比较判断反应进行的方向.
(1)固体不在平衡表达式中出现,平衡常数表达式K=c(CO2)/c(CO);反应吸热,升高温度平衡向正反应方向移动,高炉中CO2和CO的体积比值增大,平衡常数K值增大;
(2)1100℃时测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,浓度商Q=
0.025mol·L-1/0.1mol·L-1=0.25<K=0.26,说明平衡正向进行,反应未达到平衡,v正>v逆。原因:因温度不变,K值不变,![]() <0.263,未达到平衡状态,为增大
<0.263,未达到平衡状态,为增大![]() 的值,反应正向进行,故v正>v逆。
的值,反应正向进行,故v正>v逆。

【题目】在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表,完成下列问题。
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表,完成下列问题。
t/℃ | 25 | 125 | 225 | … |
K | 4.1×105 | K1 | K2 | … |
(1)该反应的化学平衡常数表达式为K=________;K1______K2(填“>”“<”或“=”);若增大压强使平衡向正反应方向移动,则平衡常数_________(填“变”或“不变”)。
(2)判断该反应达到化学平衡状态的依据是____________(填序号):
A.2υH2(正)= 3υNH3(逆) B.混合气体的密度保持不变
C.容器内压强保持不变 D.N2的消耗速率等于H2的消耗速率
E.容器中气体的平均相对分子质量不随时间而变化 F.混合气体的颜色保持不变
(3)将不同量的N2和H2分别通入到体积为2L的恒容密闭容器中,进行上述反应得到如下两组数据:
实验组 | 温度(℃) | 起始量(mol) | 平衡量(mol) | 达到平衡所需时间(min) | |
N2 | H2 | NH3 | |||
1 | 650 | 2 | 4 | 0.9 | 9 |
2 | 900 | 1 | 2 | 0.3 | 0.01 |
实验1中以υ(NH3)表示的反应速率为______,实验2的速率比实验1快的原因是____________;
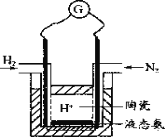
(4)有人设计采用高性能质子导电材料SCY陶瓷(能传递H+),实现了常压下既能合成氨又能发电的实验装置(如图)。则其正极的电极反应为_____________。