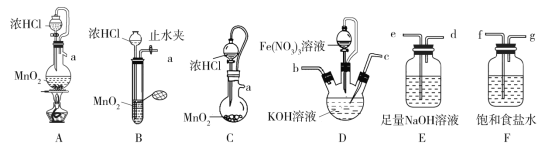
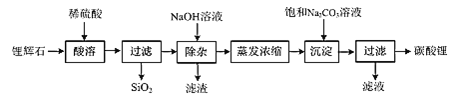
题目内容
【题目】碘单质与氢气在一定条件下反应的热化学方程式如下:
①I2(g)+H2(g)![]() 2HI(g) △H=-9.48kJ·min-1
2HI(g) △H=-9.48kJ·min-1
②I2(s)+H2(g)![]() 2HI(g) △H=+26.48kJ·min-1
2HI(g) △H=+26.48kJ·min-1
下列说法正确的是
A.该条件下,l mol H2(g)和l mol I2(g)充分反应,放出热量9.48kJ
B.该条件下,碘升华的热化学方程式为I2(s)=I2(g) △H=+35.96kJ·min-1
C.相同条件下,Cl2(g)+H2(g)=2HCl(g)的△H >-9.48 kJ·min-1
D.反应①是放热反应,所以反应①的活化能大于反应②的活化能
【答案】B
【解析】
A选项,该反应是可逆反应,该条件下,l mol H2(g)和l mol I2(g)充分反应,反应转化率达不到100%,因此放出热量小于9.48kJ,故A错误;
B选项,②-①得出:碘升华的热化学方程式为I2(s)=I2(g) △H=+35.96kJ·min-1,故B正确;
C选项,非金属越强,与氢气反应放出热量越多,因此氯气比碘蒸汽反应放出的热量多,焓变小,Cl2(g)+H2(g)=2HCl(g)的△H < -9.48 kJ·min-1,故C错误;
D选项,活化能与放热反应吸热反应无直接关系,故D错误。
综上所述,答案为B。

【题目】请按要求填写下列空白:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________________________________________;
(2)写出元素②的最简单氢化物的结构式_________________________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式____________。