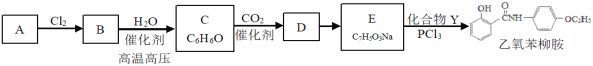
题目内容
【题目】碳酸锂广泛应用于陶瓷和医药等领域,在水中的溶解度比较小。以锂辉石(主要成分为Li2O,含有少量SiO2、Al2O3、Fe2O3)为原料制备Li2CO3的流程如图:
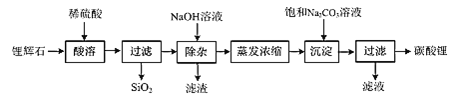
⑴写出“酸溶”时Li2O发生反应的离子方程式:______。
⑵“除杂”时所用NaOH溶液不能过量,原因是______。
⑶“除杂”时检验铁元素已完全除去的方法是______。
⑷写出“沉淀”时反应的化学方程式:______。
⑸检验最终所得碳酸锂样品中是否含有Na2CO3的方法是:______。
【答案】Li2O+2H+=2Li++H2O 若NaOH过量,Al(OH)3溶解生成NaAlO2 静置,取上层清液滴加KSCN溶液,溶液不显红色则铁元素已完全除去 Na2CO3+Li2SO4=Li2CO3↓+Na2SO4 用洁净的铁丝(或铂丝)蘸取碳酸锂样品于酒精灯外焰上灼烧,若火焰呈黄色则含Na2CO3,反之则不含
【解析】
以锂辉石(主要成分为Li2O,含有少量SiO2、Al2O3、Fe2O3)为原材料制备Li2CO3,加硫酸,浸取,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+等杂质,加入氢氧化钠溶液使Al3+、Fe3+转化为氢氧化物沉淀,过滤,将滤液蒸发浓缩,再加饱和碳酸钠溶液得到碳酸锂沉淀,过滤得到碳酸锂,据此分析解答。
(1)“酸溶”时Li2O被硫酸溶解,反应的离子方程式为Li2O+2H+=2Li++H2O,故答案为:Li2O+2H+=2Li++H2O;
(2)因氢氧化铝为两性氢氧化物,可与氢氧化钠反应,则“除杂”时所用NaOH溶液不能过量,否则Al(OH)3溶解生成NaAlO2,故答案为:若NaOH过量,Al(OH)3溶解生成NaAlO2;
(3)检验铁离子,可静置,取上层清液滴加KSCN溶液,溶液不显红色,则证明铁元素已完全除去,故答案为:静置,取上层清液滴加KSCN溶液,溶液不显红色,则铁元素已完全除去;
(4)“沉淀”时饱和碳酸钠溶液与Li+反应生成碳酸锂沉淀,反应的化学方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4,故答案为:Na2CO3+Li2SO4=Li2CO3↓+Na2SO4;
(5)可用焰色反应检验钠盐,方法是用洁净的铁丝(或铂丝)蘸取碳酸锂样品在酒精灯外焰上灼烧,若火焰呈黄色则含Na2CO3,反之则不含,故答案为:用洁净的铁丝(或铂丝)蘸取碳酸锂样品于酒精灯外焰上灼烧,若火焰呈黄色则含Na2CO3,反之则不含。

 阅读快车系列答案
阅读快车系列答案