题目内容
15.在2A+B═2C反应中,已知A的相对分子质量为24,C的相对分子质量为40,则B的相对分子质量为( )| A. | 16 g | B. | 32 g | C. | 16 | D. | 32 |
分析 根据题意,在2A+B═2C反应中,已知A的相对分子质量为24,C的相对分子质量为40,据此结合质量守恒定律,进行分析解答.
解答 解:在2A+B═2C反应中,已知A的相对分子质量为24,C的相对分子质量为40,则设B的相对分子质量为x,
2A+B═2C
48 x 80
48+x=80 x=32.相对分子质量单位是“1”,通常省略不写,故其相对分子质量为32,而不是32g.
故选:D.
点评 本题难度不大,掌握质量守恒定律、相对分子质量的计算是正确解答本题的关键.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
5.下列离子方程式书写正确的是( )
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO3-═3Br2+2NO↑+4H2O | |
| C. | Na2S溶液中滴加NClO溶液:S2-+ClO-+H2O═S↓+Cl-+2OH- | |
| D. | 双氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2═2Mn2++5O2↑+6OH-+2H2O |
6.已知25℃时有关弱酸的电离平衡常数:
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为c b d a(填序号).
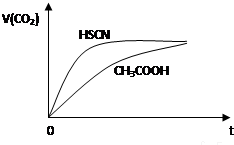
②25℃时,将20mL 0.1mol•L-1CH3COOH溶液和20mL 0.1mol•L-1HSCN溶液分别与20mL 0.1mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快.反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是a(填序号).
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数.
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
②25℃时,将20mL 0.1mol•L-1CH3COOH溶液和20mL 0.1mol•L-1HSCN溶液分别与20mL 0.1mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快.反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是a(填序号).
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数.

3.对下列常见现象进行分析,其中发生了化学变化的是( )
| A. | 煮饭前米用水洗一洗 | B. | 冰箱中放入木炭后,异味消失 | ||
| C. | 自行车轮胎在烈日下爆裂 | D. | 食物变质 |
10.在NH4NO3、N2、NO2、NO这四种物质中,N元素表现出的化合价共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
20.西班牙的瑞奥汀河是一条酸河,河水中含有硫酸和硫酸亚铁.经调查发现,酸河形成的原因是由于上游河床含有的某种物质R在水中氧的作用下发生反应所致,其反应的化学方程式为:2R+2H2O+7O2═2FeSO4+2H2SO4,则R的化学式为( )
| A. | FeS | B. | Fe2S3 | C. | FeS2 | D. | FeO |
4.充分燃烧某液态芳香烃X,并收集产生的全部水,恢复到室温时,待到水的质量跟液态芳香烃X的质量相等,则X的分子式是( )
| A. | C10H14 | B. | C11H16 | C. | C12H18 | D. | C13H20 |
5.t℃时Na2SO4的溶解度是S g,其饱和溶液密度d g•cm-3,物质的量浓度为c mol•L-1.向足量饱和溶液中,加入X g无水Na2SO4或蒸发Yg水后恢复t℃,均能获得W g芒硝晶体,下列关系式正确的是( )
| A. | c=$\frac{dS}{142(S+100)}$ mol•L-1 | B. | S=$\frac{142W}{180W+322Y}$g | ||
| C. | X=YS | D. | W=$\frac{3220X}{1420-18S}$g |