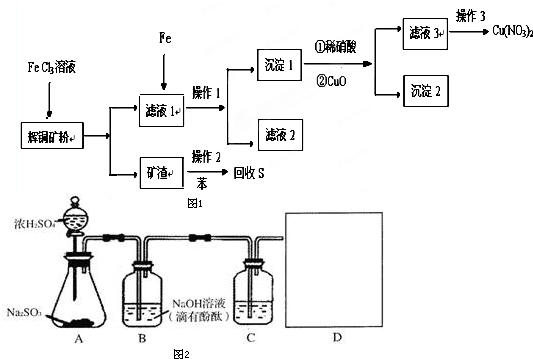
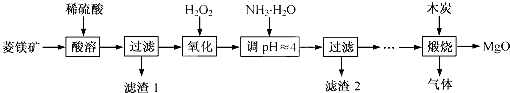
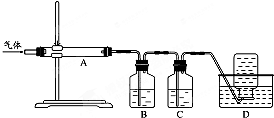
题目内容
3.在标准状况下,将22.4L的CO2气体通入到含1molNaOH的溶液中,溶质为NaHCO3,溶液中存在的离子有Na+、HCO-3、OH-、H+、CO2-3,其浓度大小顺序为(Na+)>c(HCO-3)>c(OH-)>c(H+)>c(CO2-3).分析 标况下22.4L CO2的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,NaOH的物质的量也是1mol,则发生反应:CO2+NaOH=NaHCO3,得到NaHCO3溶液,溶液中HCO-3水解程度大于其电离程度,溶液呈碱性,溶液中H+源于水与HCO-3的电离.
解答 解:标况下22.4L CO2的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,NaOH的物质的量也是1mol,则发生反应:CO2+NaOH=NaHCO3,得到NaHCO3溶液,溶液中存在的离子有Na+、HCO-3、OH-、H+、CO2-3,溶液中HCO-3水解程度大于其电离程度,溶液呈碱性,溶液中H+源于水与HCO-3的电离,溶液中离子浓度:c(Na+)>c(HCO-3)>c(OH-)>c(H+)>c(CO2-3),
故答案为:NaHCO3;Na+、HCO-3、OH-、H+、CO2-3;(Na+)>c(HCO-3)>c(OH-)>c(H+)>c(CO2-3).
点评 本题考查化学方程式计算、离子浓度大小比较等,关键是判断反应产物,注意掌握离子浓度大小比较.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
13.为了得到比较纯净的物质,使用的方法恰当的是( )
| A. | 向Na2CO3饱和溶液中,通入过量的CO2后,加热、蒸发得到NaOH晶体 | |
| B. | 向Fe2(SO4)3溶液加入足量NaOH溶液,经过过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 |
18.除去河水中的悬浮杂质,使河水变澄清,可选用的试剂是( )
| A. | 漂白粉 | B. | 液氯 | C. | 明矾 | D. | 胆矾 |
8.下列有关生活中的化学,说法不正确的是( )
| A. | 银氨溶液可以用于区分麦芽糖和蔗糖 | |
| B. | 福尔马林可制备标本是利用了使蛋白质变性的性质 | |
| C. | 棉花和蚕丝的主要成分都是纤维素 | |
| D. | 食用植物油的主要成分是高级不饱和脂肪酸甘油酯 |