��Ŀ����
3��ijͭ��ʯ����Ҫ��������ͭ��Cu2S����������ʯ��SiO2�����Ѹ�ͭ��ʯ������ѡ�����������������ͭ�Ĺ���������ͼ1��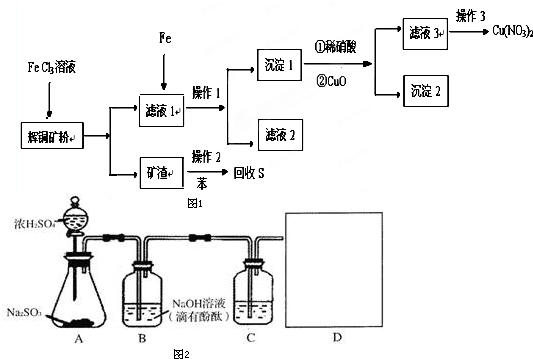
��1��д����ʯ��������FeCl3��Һ����S����ʱ���������ӷ���ʽ2Fe3++S2-=2Fe2++S��д������2��Ҫ�õ��IJ��������������ձ���©������������
��2��Ϊ��֤����Ĵ�������Ҫ�Գ���1����ϴ�ӣ�д��ϴ�ӵIJ������̰ѹ�������������©���У���©���м�������ˮ����û���壬��ˮ��Ȼ���������ظ�2-3�Σ�
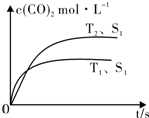
��3�����ջ�ͭ������������Ⱦ��SO2��ʵ����̽��SO2�����ʣ�����ͼ2װ�ý���ʵ�飮
ʵ���У�����װ��B����Һ��ɫ��Ϊ��ɫ������ͬѧ�²�������SO2����������ģ���ͬѧ�²�������SO2��Ư��������ģ�
������Ϊ�IJ²���ȷ������Ƽ�ʵ��֤����������ɫ����Һ�м���NaOH����Һ�ֱ��ɫ�������ȷ��
��װ��C��֤��SO2���л�ԭ�ԣ���C�е���Һ��ѡ��KMnO4 ���ѧʽ������֤SO2���л�ԭ�Ե�ʵ������Ϊ��Һ��ɫ��ȥ��
�۸�ʵ��ʣ���SO2��Ҫ���մ�������D�����ڻ���β������װ��ͼ��ָ�������Լ���
���� �����Ӿ��������ԣ����Խ�Cu+����ΪCu2+����S2-����ΪS�����˵õ���Һ1�к���CuCl2��ʣ���FeCl3���õ��Ĺ����к���S��SiO2�������м��뱽�����˵õ���ı���Һ������ΪSiO2����Һˮԡ���Ȼ������ʼ�����
����Һ��1�����������������л�ԭ�ԣ������ӡ�ͭ���Ӿ��������ԣ����������������Ӧ����ԭ����Ӧ�����ӷ�Ӧ����ʽ�ֱ�Ϊ��Fe+2Fe3+=3Fe2+��Fe+Cu2+=Cu+Fe2+���پ������ˣ���Һ2������ΪFeCl2������1����Cu��ʣ���Fe����������ϡ���ᷴӦ�õ�����ͭ�����������ټ���CuO��������ҺpH��ʹFe3+ת��ΪFe��OH��3����������Һ�г�ȥ���ٹ��˵õ���Һ3Ϊ����ͭ��Һ�����ͨ������Ũ������ȴ�ᾧ�õ�����ͭ���壻
��1���Ȼ�����Һ���������ԣ���������������Ϊ���ʣ��Ȼ�������ԭΪ�Ȼ�����������2�Ƿ���������Һ��ʵ������ǹ��ˣ��ݴ�ѡ����Ҫ�IJ���������
��2�����ݳ���ϴ�ӵ�ʵ��װ�úͲ���ش�
��3�������ײ�����ȷ�����������Ʒ�Ӧ���̪��ɫ����Ƽ�ʵ��֤��Ϊ��������ɫ����Һ�м���NaOH����Һ�ֱ��ɫ�������ȷ��������ȷ���Ƕ��������Ư���Ծ���ѡ���ԺͿ����ԣ���Ƶ�ʵ��Ϊ��������ɫ�����Һ���ȣ���Һ�ָ���ɫ��������ȷ��
�ڿ������ö�������Ļ�ԭ���������Ե�KMnO4��Һ��Ӧ����������жϣ�
�۶���������������β����Ũ�������������գ�
��� �⣺��1���Ȼ�����Һ���������ԣ���������������Ϊ���ʣ��Ȼ�������ԭΪ�Ȼ���������Ӧ�����ӷ���ʽΪ��2Fe3++S2-=2Fe2++S��������2�Ƿ���������Һ��ʵ������ǹ��ˣ��ݴ�ѡ����Ҫ�IJ���������©�����ձ��Ͳ�������
�ʴ�Ϊ��2Fe3++S2-=2Fe2++S����©�����ձ�����������
��2��Ϊ��֤����Ĵ�������Ҫ�Գ���1����ϴ�ӣ���Ҫ�������ǹ�������ϴ�ӵIJ�������Ϊ���ѹ�������������©���У���©���м�������ˮ����û���壬��ˮ��Ȼ���������ظ�2-3�Σ�
�ʴ�Ϊ���ѹ�������������©���У���©���м�������ˮ����û���壬��ˮ��Ȼ���������ظ�2-3�Σ�
��3����ʵ���У�����װ��B����Һ��ɫ��Ϊ��ɫ������ͬѧ�²�������SO2����������ģ���ͬѧ�²�������SO2��Ư��������ģ����ײ�����ȷ����Ƽ�ʵ��֤��Ϊ��������ɫ����Һ�м���NaOH����Һ�ֱ��ɫ�������ȷ��������ȷ����Ƶ�ʵ��Ϊ��������ɫ�����Һ���ȣ���Һ�ָ���ɫ��������ȷ��
�ʴ�Ϊ���ף�������ɫ����Һ�м���NaOH����Һ�ֱ��ɫ�������ȷ��������ȷ����Ƶ�ʵ��Ϊ��������ɫ�����Һ���ȣ���Һ�ָ���ɫ��������ȷ��
��װ��C��֤��SO2���л�ԭ�ԣ��������ö�������Ļ�ԭ���������Ե�KMnO4��Һ��Ӧ��֤������������ͨ�����Ը��������Һ����Һ��ɫ��ȥ֤������������л�ԭ�ԣ�
�ʴ�Ϊ��KMnO4����Һ��ɫ��ȥ��
�۶���������������β����Ũ�������������գ�װ��Ϊ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
���� ���⿼��������ʵ���Ʊ����̣�ʵ����ƺͷ�Ӧ����ķ���Ӧ�ã���Ҫ���������ʵ�����Ӧ�ã����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� | Cu2+��K+��Mg2+��NO3- | B�� | Na+��Cl-��I-��SO42- | ||
| C�� | H2PO4-��NO-3��NH4+��NO3- | D�� | S2O32-��AlO2-��Na+��Cl- |
 2013���������������Ű�ҹ��ж������������У�����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ��
2013���������������Ű�ҹ��ж������������У�����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ����1��CO2�Ǵ����к�����ߵ�һ���������壬���ƺ�����CO2�ǽ������ЧӦ����Ч;����Ŀǰ����CO2���ϳɶ�������ȡ���˽ϴ�Ľ�չ���仯ѧ��Ӧ�ǣ�
2CO2��g��+6H2��g��?CH3OCH3��g��+3H2O��g����H��0��
��д���÷�Ӧ��ƽ�ⳣ������ʽ$\frac{c��C{H}_{3}OC{H}_{3}����{c}^{3}��{H}_{2}O��}{{c}^{2}��C{O}_{2}����{c}^{6}��{H}_{2}��}$��
���жϸ÷�Ӧ��һ�������£�����㶨���ܱ��������Ƿ�ﵽ��ѧƽ��״̬��������BD��
A���������ܶȲ��� B����λʱ��������2molCO2��ͬʱ����1mol������
C��v��CO2����v��H2��=1��3 D��������ѹǿ���ֲ���
��2������β����������Ҫԭ��Ϊ��2NO��g��+2CO��g�� $\stackrel{����}{?}$2CO2��g��+N2 ��g��
���ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯���ߣ���ͼ��ʾ���ݴ��жϣ�
�ٸ÷�Ӧ�ġ�H��0��ѡ�����������������
�ڵ��������������һ��ʱ�����������������ѧ��Ӧ���ʣ��������ı����S1��S2����ͼ�л���c��CO2����T2��S2�����´ﵽƽ������еı仯���ߣ�
��3����֪��CO��g��+2H2��g��?CH3OH��g����H=-a kJ•mol-1��
�پ��ⶨ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����£�
| �¶ȣ��棩 | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
��ij�¶��£�������̶���2L���ܱ������н�1mol CO��2mol H2��ϣ���ò�ͬʱ�̵ķ�Ӧǰ��ѹǿ��ϵ���£�
| ʱ�䣨min�� | 5 | 10 | 15 | 20 | 25 | 30 |
| ѹǿ�ȣ�P��/Pǰ�� | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
��4��Һ����Ϊһ��DZ�ڵ��������ȼ����Խ��Խ���о���Ա���ӣ����ڰ�ȫ�ԡ��۸�ȷ���ϻ�ʯȼ�Ϻ���ȼ�����Žϴ�����ƣ�����ȼ��ʵ������صķ�Ӧ�У�
4NH3��g��+3O2��g��=2N2��g��+6H2O��l����H1 ��
4NH3��g��+5O2��g��=4NO��g��+6H2O��l����H2 ��
4NH3��g��+6NO��g��=5N2��g��+6H2O��l����H3 ��
��д������������Ӧ�С�H1����H2����H3����֮���ϵ�ı���ʽ����H1=$\frac{3��{H}_{2}+2��{H}_{3}}{5}$��
��5������Simons�ȿ�ѧ�ҷ�����ʹNH3ֱ������ȼ�ϵ�صķ�������װ��Ϊ�ò���Ϊ�缫������KOH�������Һ�У����ط�ӦΪ 4NH3+3O2=2N2+6H2O��д����ȼ�ϵ�ص�������ӦʽO2+2H2O+4e-=4OH-��

 ������COCl2����һ����Ҫ�Ļ���ԭ�ϣ�����ũҩ��ҽҩ����������ϵ���������ҵ��ͨ��Cl2��g��+CO��g��?COCl2��g����H��0�Ʊ�����ͼ1Ϊij��ģ��ʵ���о��������ݻ�Ϊ1L���ܱ������ڸ����ʵ�Ũ����ʱ��仯�����ߣ��ش��������⣺
������COCl2����һ����Ҫ�Ļ���ԭ�ϣ�����ũҩ��ҽҩ����������ϵ���������ҵ��ͨ��Cl2��g��+CO��g��?COCl2��g����H��0�Ʊ�����ͼ1Ϊij��ģ��ʵ���о��������ݻ�Ϊ1L���ܱ������ڸ����ʵ�Ũ����ʱ��仯�����ߣ��ش��������⣺