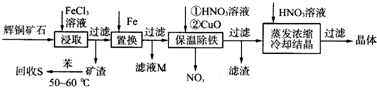
题目内容
7.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g),经过5分钟后,测得D的浓度为0.5mol/L,C的平均反应速率是0.1mol/(L•min),且c(A):c(B)=3:5.求:(1)此时A的浓度.
(2)反应开始前放入容器中A、B的物质的量.
(3)B的平均反应速率.
(4)x值为多少.
分析 将等物质的量的A、B混合于2L的密闭容器中,经过5分钟后,测得D的浓度为0.5mol/L,生成D的物质的量为0.5mol/L×2L=1mol,则:
3A(g)+B(g)=xC(g)+2D(g)
起始量(mol):a a 0 0
变化量(mol):1.5 0.5 0.5x 1
5min后(mol):a-1.5 a-0.5 0.5x 1
5min后c(A):c(B)=3:5,则(a-1.5):( a-0.5)=3:5,解得a=3.
(1)根据c=$\frac{n}{V}$计算5min后A的浓度;
(2)由分析可知A、B起始物质的量;
(3)根据v=$\frac{△c}{△t}$计算v(B);
(4)结合C的速率计算x的值.
解答 解:将等物质的量的A、B混合于2L的密闭容器中,经过5分钟后,测得D的浓度为0.5mol/L,生成D的物质的量为0.5mol/L×2L=1mol,则:
3A(g)+B(g)=xC(g)+2D(g)
起始量(mol):a a 0 0
变化量(mol):1.5 0.5 0.5x 1
5min后(mol):a-1.5 a-0.5 0.5x 1
5min后c(A):c(B)=3:5,则(a-1.5):( a-0.5)=3:5,解得a=3.
(1)5min后A的浓度为$\frac{(3-1.5)mol}{2L}$=0.75mol/L,
答:5min后A的浓度为0.75mol/L;
(2)由上述分析,可知A、B起始物质的量为3mol,
答:A、B起始物质的量为3mol;
(3)v(B)=$\frac{\frac{0.5mol}{2L}}{5min}$=0.05mol/(L.min),
答:B的平均反应速率为0.05mol/(L.min);
(4)0.5x mol=0.1mol/(L•min)×5min×2L,解得x=2,
答:x的值为2.
点评 本题考查化学平衡计算,难度不大,注意三段式解题法在化学平衡计算中应用.

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案| A. | CO2在高压、低温下变成雪状固体 | |
| B. | CO2通入澄清的石灰水,石灰水变浑浊 | |
| C. | CO2通入紫色石蕊试液,试液变红色 | |
| D. | CO2通过赤热的炭变成CO |
 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.
①写出该反应的平衡常数表达式$\frac{c(C{H}_{3}OC{H}_{3}).{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2}).{c}^{6}({H}_{2})}$.
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是BD.
A.容器中密度不变 B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2):v(H2)=1:3 D.容器内压强保持不变
(2)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$2CO2(g)+N2 (g)
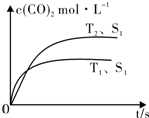
在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H<0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线.
(3)已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ•mol-1.
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
(4)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨在燃烧实验中相关的反应有:
4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H1 ①
4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H2 ②
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1=$\frac{3△{H}_{2}+2△{H}_{3}}{5}$.
(5)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置为用铂作为电极,加入KOH电解质溶液中,其电池反应为 4NH3+3O2=2N2+6H2O,写出该燃料电池的正极反应式O2+2H2O+4e-=4OH-.
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 任意比 |
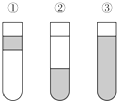 在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示的现象,正确的结论是( )
在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示的现象,正确的结论是( )| A. | ①加CCl4 ②加苯 ③加酒清 | B. | ①加酒精 ②加CCl4 ③加苯 | ||
| C. | ①加苯 ②加CCl4 ③加酒精 | D. | ①加苯 ②加酒精 ③加CCl4 |
| A. | MnO2与浓盐酸混合加热:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | (NH4)2Fe(SO4)2溶液中加入过量的NaOH溶液:Fe2++2OH-=Fe(OH)2↓ | |
| C. | Ba(HCO3)2溶液中加入稀硫酸:Ba2++SO${\;}_{4}^{2-}$=BaSO4↓ | |
| D. | H2C2O4(弱酸)溶液中加入酸性KMnO4溶液:2MnO${\;}_{4}^{-}$+5H2C2O4=2Mn2++10CO2↑+2H2O+6OH- |