题目内容
13.为了得到比较纯净的物质,使用的方法恰当的是( )| A. | 向Na2CO3饱和溶液中,通入过量的CO2后,加热、蒸发得到NaOH晶体 | |
| B. | 向Fe2(SO4)3溶液加入足量NaOH溶液,经过过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 |
分析 A.通入过量的CO2后,反应生成碳酸氢钠;
B.向Fe2(SO4)3溶液加入足量NaOH溶液,反应生成氢氧化铁沉淀;
C.加入过量的氯水,反应生成氯化铁,加热促进水解;
D.加热促进氯化铝水解.
解答 解:A.通入过量的CO2后,反应生成碳酸氢钠,加热蒸发得到碳酸氢钠固体,灼烧得到碳酸钠,不能得到NaOH,故A错误;
B.向Fe2(SO4)3溶液加入足量NaOH溶液,反应生成氢氧化铁沉淀,过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3,故B正确;
C.加入过量的氯水,反应生成氯化铁,加热促进水解,则加热蒸发得到Fe(OH)3,故C错误;
D.加热促进氯化铝水解,则加热蒸发得到Al(OH)3,故D错误;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、盐类水解及发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
1.NH3及其盐都是重要的化工原料.
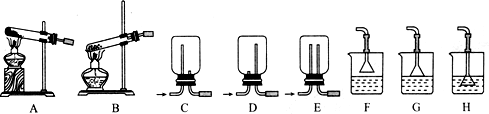
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为A、C、G(填字母).
(2)恒定温度下在特制的密闭真空容器中充入2molNH3、1molCO2,发生反应制备氨基甲酸铵 2NH3(g)+CO2(g) NH2COONH4(s)(假设固体试样体积忽略不计).若容器体积不变,可以判断该反应已经达到化学平衡的是BC(填字母).
A.υ(NH3)=2υ(CO2) B.密闭容器中总压强不变 C.密闭容器中混合气体的密度不变
上述反应达到平衡后,若在恒温下压缩容器体积,重新达平衡后混合气体中NH3的体积分数不变(填“增加”、“减小”或“不变”).
(3)铵盐在水溶液中建立如下水解平衡:NH4Cl+H2ONH3•H2O+HCl,研究表明,浓度、温度、pH均对铵盐水解程度(即上述反应中中NH4Cl的转化率)产生影响.某兴趣小组探究某一种因素对溶液中NH4Cl水解程度的影响.
试剂与仪器:固体NH4Cl、蒸馏水、100 mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可控制温度).
设计实验方案,pH为拟测定的数据,表中V(溶液)表示所配制NH4Cl溶液的体积.
请分析,实验1、2的目的是探究温度对溶液中NH4Cl水解程度的影响,实验2、3的目的是探究NH4Cl浓度对溶液中NH4Cl水解程度的影响.
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为A、C、G(填字母).

(2)恒定温度下在特制的密闭真空容器中充入2molNH3、1molCO2,发生反应制备氨基甲酸铵 2NH3(g)+CO2(g) NH2COONH4(s)(假设固体试样体积忽略不计).若容器体积不变,可以判断该反应已经达到化学平衡的是BC(填字母).
A.υ(NH3)=2υ(CO2) B.密闭容器中总压强不变 C.密闭容器中混合气体的密度不变
上述反应达到平衡后,若在恒温下压缩容器体积,重新达平衡后混合气体中NH3的体积分数不变(填“增加”、“减小”或“不变”).
(3)铵盐在水溶液中建立如下水解平衡:NH4Cl+H2ONH3•H2O+HCl,研究表明,浓度、温度、pH均对铵盐水解程度(即上述反应中中NH4Cl的转化率)产生影响.某兴趣小组探究某一种因素对溶液中NH4Cl水解程度的影响.
试剂与仪器:固体NH4Cl、蒸馏水、100 mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可控制温度).
设计实验方案,pH为拟测定的数据,表中V(溶液)表示所配制NH4Cl溶液的体积.
| 物理量 实验序号 | V(溶液)/mL | NH4Cl/g | 温度/℃ | pH | … |
| 1 | 100 | m | T1 | … | |
| 2 | 100 | m | T2 | … | |
| 3 | 100 | 2m | T2 | … |
8.下列有关实验室常用仪器和实验操作正确的是( )
| A. | 实验室用浓硫酸和乙醇制乙烯时,应把温度计的水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 用浓硫酸配置一定物质的量浓度的稀硫酸时,应在量取浓硫酸后,用蒸馏水洗涤量筒并将洗涤液转移到小烧杯中 | |
| C. | 液态溴应贮存在磨口的细口瓶中,加水液封,加盖橡胶塞,并放置于阴凉处 | |
| D. | 应用渗析法提纯胶体时,要不断更换烧杯中的水(或用流动的水)以提高渗析效果 |
2.下列变化属于氧化还原反应的是( )
| A. | CO2在高压、低温下变成雪状固体 | |
| B. | CO2通入澄清的石灰水,石灰水变浑浊 | |
| C. | CO2通入紫色石蕊试液,试液变红色 | |
| D. | CO2通过赤热的炭变成CO |
 .
.